题目内容
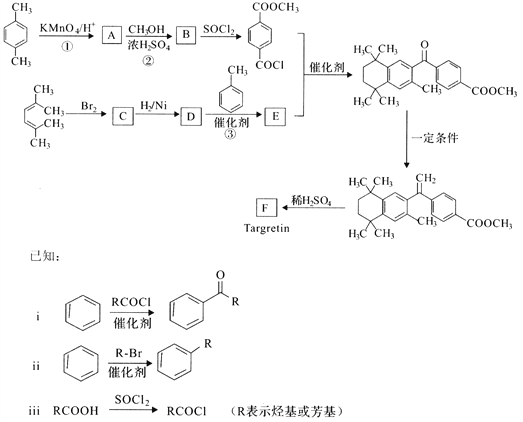
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。

(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:______________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为____________________。此反应的发生说明了_____________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是_________________。
【答案】H2NaCl②④2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2OCa(ClO)2+CO2 +H2O =CaCO3+2HClO符合强酸制取弱酸的原理,酸性H2CO3>HClO有黄绿色气体生成
2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2OCa(ClO)2+CO2 +H2O =CaCO3+2HClO符合强酸制取弱酸的原理,酸性H2CO3>HClO有黄绿色气体生成
【解析】
根据①是工业上生产化合物D的反应,该反应是C在高温下分解生成D和E的反应;反应⑤是实验室检验化合物E的反应,该反应生成C和B,可以推断:C为碳酸钙、E为二氧化碳、D是氧化钙、G为氢氧化钙、B是水。由题中信息可知,除反应①以外,还有两个用于工业生产的反应,则反应②为电解饱和食盐水的反应、反应④是制备漂白粉的反应,因此可以推断:A为氯化钠、H为氯气、L为氢气、M为氢氧化钠,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,J和K两者必有一种是次氯酸钙。
(1)根据上述分析可知单质L是H2;化合物A是NaCl;
(2)除反应①以外,还有两个用于工业生产的反应,则反应②为电解饱和食盐水的反应、反应④是制备漂白粉的反应,两反应的化学方程式分别为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑、2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑、2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O;
(3)E是二氧化碳,J和K两者必有一种是次氯酸钙,二氧化碳和次氯酸钙溶液可以发生反应,该反应的化学方程式为:Ca(ClO)2+CO2 +H2O =CaCO3+2HClO,该反应符合强酸制取弱酸的原理,可证明酸性H2CO3>HClO;
(4)次氯酸钙可以和浓盐酸反应生成氯气,故可以观察到有黄绿色气体生成。

 学习实践园地系列答案
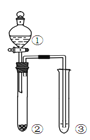
学习实践园地系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D