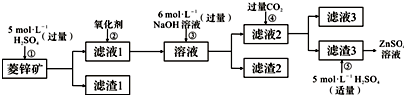
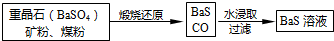
题目内容
13.据报道,在40GPa高压下,用激光器加热到1800K,科学家已成功合成出CO2原子晶体,下列有关这种CO2晶体推断正确的是( )| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
分析 A.原子晶体熔沸点较高;
B.二氧化碳晶体中,每个碳原子连接四个O原子,每个O原子连接两个C原子;
C.原子晶体硬度大、熔沸点较高;
D.有新物质生成的变化是化学变化.
解答 解:A.二氧化碳原子晶体熔沸点较高,不易液化,所以不能作制冷剂,故A错误;
B.CO2原子晶体与SiO2结构类似,每个碳原子与4个氧原子通过1对共用电子对连接,每个氧原子与2个碳原子通过1对共用电子对连接,故B错误;
C.原子晶体硬度大,耐磨,所以可以作耐磨材料,故C正确;
D.CO2原子晶体转化为CO2分子晶体,结构已发生改变,且二者的性质也有较大差异,故二者是不同的物质,二者的转变是化学变化,故D错误;
故选C.
点评 本题考查晶体空间结构、晶体性质及基本概念,侧重考查学生空间想象能力、知识迁移能力等知识点,以二氧化硅等原子晶体为例采用知识迁移的方法解答即可,易错选项是D.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
3.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,下列叙述正确的是( )
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |
4.下列有关实验操作和说法中,正确的是( )
| A. | 苯酚中滴加少量的稀溴水出现了1-溴苯酚的白色沉淀 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
1.下列说法正确的是( )
| A. | 浓硫酸可做为H2、NH3等气体的干燥剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 足量的锌与一定量的浓硫酸反应会生成氢气 | |
| D. | 可用铝罐储运热的浓硫酸、浓硝酸 |
8.下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为 .
.
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
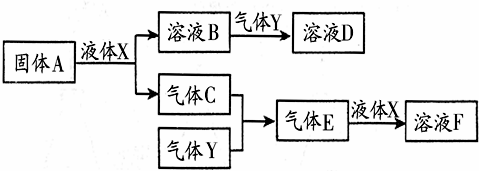
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.

18.下列电子式正确的是( )
| A. | H2O2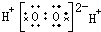 | B. | CCl4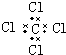 | C. | MgCl2 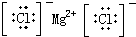 | D. | NaOH 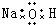 |
5.设阿伏加德罗常数的数值为NA,则下列说法正确的是( )
| A. | 15 g甲基所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |
2.如图是四种常见有机物的比例模型示意图.下列说法正确的是( )
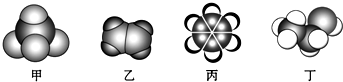

| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与酸性高锰酸钾发生加成反应 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. | 丁可与乙酸发生中和反应 |