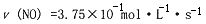题目内容
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/10-4 mol·L-1 |
10.0 |
4.05 |
2.50 |
1.60 |
1.00 |
1.00 |
|
c(CO)/10-3 mol·L-1 |
3.60 |
3.05 |
2.85 |
2.76 |
2.70 |
2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
【答案】
C
【解析】
试题分析:A、化学反应速率v= =9×10-5
mol/(L·s),故A正确;B、夏天气温较高气体热胀冷缩使等物质的量的体积增大,使同等状况下的化学平衡向正反应方向进行,使夏天转化率比冬天高,故B正确;C、弱体积增大反应向逆反应方向进行,反应时吸收热量,故C错误;D、2NO(g)+2CO(g)=N2(g)+2CO2(g)
=9×10-5
mol/(L·s),故A正确;B、夏天气温较高气体热胀冷缩使等物质的量的体积增大,使同等状况下的化学平衡向正反应方向进行,使夏天转化率比冬天高,故B正确;C、弱体积增大反应向逆反应方向进行,反应时吸收热量,故C错误;D、2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3mol 0 0
变化浓度:9×10-4 9×10-4 9×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 9×10-4 9×10-4
即K= =5000,故D正确。
=5000,故D正确。
考点:化学平衡的计算

练习册系列答案
相关题目
汽车上的催化转化器,可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ?mol-1,在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表:
经分析,得出结论不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol?L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A、该反应转化较快,具有存实际意义 |
| B、催化转化器在冬季时对废气转化效率比夏季更高 |
| C、2s末的平均反应速率v(NO)=3.75×10-4mol?L-1?S1 |
| D、在该温度下,反应的平衡常数K=5000 |
 (2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:
(2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:

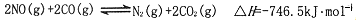 在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表