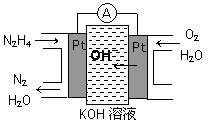
题目内容
写出下列各离子反应方程式
(1)氢氧化铝和盐酸的反应________
(2)钠和盐酸的反应________
(3)钠和硫酸铜的反应 ________
试题分析:(1)氢氧化铝是弱碱,不能拆;(2)钠与盐酸反应,生成氯化钠和氢气,注意气体符号;(3)钠与硫酸铜反应,实质是钠先与水反应,生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应,生成硫酸钠和氢氧化铜。
考点:离子方程式
点评:离子方程式的书写为历年高考的重点,考生应熟记其书写规则,并灵活运用。

| 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A∶C | B∶A | D∶E | B∶E |
1∶1 | 1∶2 | 1∶3 | 1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个。在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,D和E的原子序数之和为30。
(1)写出元素符号:A___________,B___________,C___________,D___________,E___________。
(2)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(3)已知乙的式量小于甲,在实验室中常用什么方法制得乙:______________________
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式为______________________。
(5)向3 mL 1 mol·L-1KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL丁。经充分振荡后静置,可得到紫色溶液,这种紫色溶液是___________。
(14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
6.34 |
9.7 |
|
Fe3+ |
1.48 |
3.2 |
|
Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。