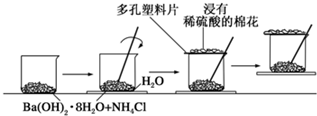
题目内容
在标准状况下,1120 L N2和3360 L H2相混合通入合成塔,在一定条件下反应达到平衡,从合成塔出来的混合气体在标准状况下的密度为0.64 g·L-1,求N2的转化率。若将混合气体通过水得8 L溶液,求其物质的量浓度。
81.4% 10.2 mol·L-1
解析:n(N2)=![]() =50 mol
=50 mol
n(H2)= ![]() =150 mol
=150 mol
设达到平衡时,有x mol N2转化为NH3
则有 N2 + 3H2 ![]() 2NH3
2NH3
起始 50 mol 150 mol 0
变化 x mol 3 x mol 2x mol
平衡(50-x) mol (150-3x) mol 2x mol
有50×28+150×2=(50-x+150-3x+2x)×22.4×0.64
解之得x≈40.7
得N2转化率为![]() ×100%=81.4%,反应生成氨:2×40.7 mol=81.4 mol
×100%=81.4%,反应生成氨:2×40.7 mol=81.4 mol
c(NH3)=![]() ≈10.2 mol·L-1
≈10.2 mol·L-1

练习册系列答案
相关题目
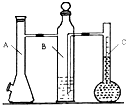 在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)( )
在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)( )| A、102.7 mL | B、112.7 mL | C、92.7 mL | D、122.7 ml |