��Ŀ����
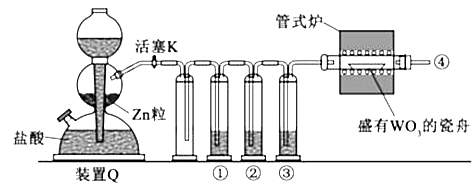
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ1�� 
��1������������������ȷ˳������ӿڴ�����ĸ������E�������������� ��
��2��װ���У�Ũ�������������NaOH��Һ�������� ��
��3����ѧʵ���г���ʪ��ĵ��۩�KI��ֽ�����Ƿ���Cl2�����������Cl2�������ɹ۲쵽
��4��д�����л�ѧ��Ӧ�ķ���ʽ�� �����巢��װ���н��еķ�Ӧ��
��NaOH��Һ�з�����Ӧ�����ӷ���ʽ��
������0.05mol Al3+��Fe3+����Һ�е���1mol/L NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ��ͼ2��ʾ������Һ��Al3+���ʵ���Ϊ ��
���𰸡�
��1��C�� D�� A�� B�� G�� H�� F
��2����ȥ�����е�H2O��g�������չ���������
��3����ֽ����
��4��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��2OH��+Cl2=Cl��+ClO��+H2O��0.035mol
MnCl2+Cl2��+2H2O��2OH��+Cl2=Cl��+ClO��+H2O��0.035mol
���������⣺��1����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿������������Ҫ����װ�������������ñ���ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ܳ����̴��ռ����������������������Һ���ն����������װ������˳���ǣ�E��C��D��A��B��G��H��F��
��Ϊ��C D A B G H F����2��Ũ����������dz�ȥ�����е��Ȼ������壻NaOH�����������չ�������������ֹ��Ⱦ������
���Դ��ǣ���ȥ�����е�H2O��g�������չ�����������3���ٷ���װ�����Ƕ������̺�Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�������ж�������������Һ���գ��������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Cl2+2OH��=Cl��+ClO��+H2O��
���Դ��ǣ�Cl2+2OH��=Cl��+ClO��+H2O��
����ͼ���֪����������ȫ����ʱ����185mL�������ƣ�������0.185molNaOH���躬��xmolAl3+��ymolFe3+���漰���ӷ���ʽΪ
Fe3++ | 3OH��=Fe��OH��3�� | Al3++ | 4OH��=AlO2��+2H2�� |
y | 3y | x | 4x |
�� x+y=0.05��
4x+3y=0.185��
�����������֮��x=0.035 y=0.015 ���Դ��ǣ�0.035mol
�����㾫��������������ʵ�����Ʒ��ǽ����ĸ�������Ҫ֪��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��