题目内容
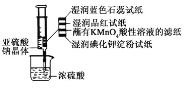
【题目】(一)某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:利用如图装置可以验证元素的非金属性的变化规律。
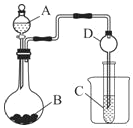
(1)图中:A装置名称是___,干燥管D的作用是___。
(2)实验室中现有药品Na2S、KMnO4、MnO2、浓盐酸,请从中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的离子方程式为___。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
装置A、C中所选试剂分别为__(填序号);能说明酸性H2CO3>H2SiO3的实验现象是__。
(二)四种短周期元素W、X、Y、Z,原子序数依次增大,请回答下列问题。
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于___族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是___(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是___(填序号)。
a.自然界中的含量
b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度
d.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因:___。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是__。
【答案】分液漏斗 防止倒吸 2MnO4+10Cl+16H+=2Mn2++5Cl2+8H2O ①④ C试管中出现白色(胶状)沉淀 ⅣA Na cd 电子层相同,核电荷数Al>Na HN3+NaOH=NaN3+H2O
【解析】
(一)(1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;烧瓶中酸性高锰酸钾溶液能够氧化氯离子;
(3)要证明非金属性:N>C>Si,则利用此装置证明最高价氧化物对应水化物的酸性的强弱顺序为:HNO3>H2CO3>H2SiO3;C装置中硅酸钠转化成硅酸沉淀,则证明碳酸的酸性大于硅酸;
(二)四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,且Al2O3为两性氧化物;Z最高正价与最低负价之和为零,则Z为Si元素,
(1)主族元素族序数=最外层电子数;
(2)W、X、Y、Z形成的最高价氧化物的水化物分别是硝酸、氢氧化钠、氢氧化铝、硅酸,氢氧化钠和其他三种物质均能反应;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度等,与得失电子数目多少无关;
②电子层相同、核电荷数越大原子半径越小,原子核对核外电子吸引越强;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,等体积、等浓度的HN3、NaOH溶液恰好反应得到NaN3溶液,据此写出反应的化学方程式。
(一)(1)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入圆底烧瓶中;
故答案为:分液漏斗;防止倒吸;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,烧瓶中发生反应的离子方程式为:2MnO4-+10Cl+16H+=2Mn2++5Cl2+8H2O;
故答案为:2MnO4-+10Cl+16H+=2Mn2++5Cl2+8H2O;
(3)根据强酸制弱酸的原理,利用稀硝酸溶解碳酸钙,将生成的CO2通入硅酸钠溶液中即可推断酸性的弱顺序为:HNO3>H2CO3>H2SiO3,即A为稀硝酸、B为碳酸钙、C为硅酸钠溶液;当C试管中出现白色(胶状)沉淀时,证明酸性H2CO3>H2SiO3;
故答案为:①④;C试管中出现白色(胶状)沉淀;
(二)四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,且Al2O3为两性氧化物;Z最高正价与最低负价之和为零,则Z为Si元素,
(1)Z是Si元素,处于第ⅣA族;
故答案为:ⅣA;
(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质均能反应,所以该元素是Na;
故答案为:Na;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度等,与得失电子数目多少无关;
故答案为:cd;
②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,则失电子能力Na>Al,金属性Na>Al;
故答案为:电子层相同,核电荷数Al>Na;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O;
故答案为:HN3+NaOH═NaN3+H2O。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )
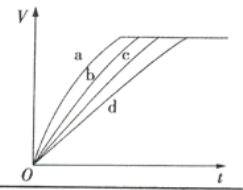
实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
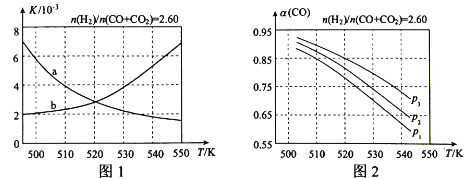
【题目】二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。