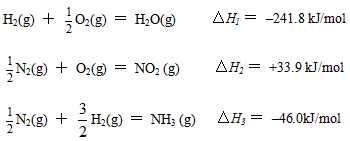题目内容
向含有1.17g NaCl和1.17g NaF的溶液中,加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥后称其质量为2.87g。根据此实验确定AgF在水中的溶解性应为( )
A.易溶于水 B.此AgCl更难溶于水
C.与AgCl一样难溶于水 D.无法确定根据下列反应
A
【解析】
试题分析:氯化钠和氟化钠的物质的量分别是1.17g÷58.5g/mol=0.02mol、1.17g÷42g/mol=0.028mol。生成的氯化银质量是0.02mol×143.5g/mol=1.87g,这说明生成的AgF是易溶于水的,答案选A。
考点:考查NaX和硝酸银反应的有关判断和计算
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生解题能力的培养,意在培养学生分析、归纳、总结问题的能力,也有了培养学生的逻辑思维能力和逆向思维能力。

 阅读快车系列答案
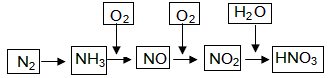
阅读快车系列答案工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示:
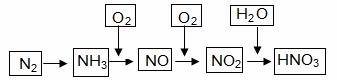 |
请回答:
(1)NO2与H2O反应中的还原剂是 。
(2)NH3与O2制取NO的化学反应方程式 。
(3)下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为 。
(5)已知:
H2(g) + ![]() O2(g) = H2O(g) △H1 = 241.8 kJ/mol
O2(g) = H2O(g) △H1 = 241.8 kJ/mol
![]() N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
![]() N2(g) +
N2(g) + ![]() H2(g) = NH3 (g) △H3 = 46.0kJ/mol
H2(g) = NH3 (g) △H3 = 46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H= kJ/mol。
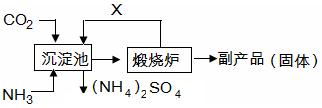
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4) 2SO4的工艺流程如下:
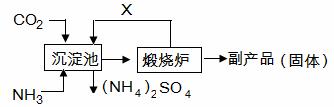 |
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。