题目内容
7.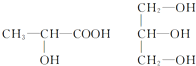 按要求完成下列问题.
按要求完成下列问题.(1)写出Mg2+的电子排布式1s22s22p6.
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:Co3+、CN-、6.
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:平面正三角形、sp2、120°.
(4)下列(如图)分子中若有手性分子,请用“*”标出其手性碳原子.
分析 (1)Mg2+含有10个电子,核外电子排布式为1s22s22p6;
(2)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(3)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角;
(4)连接4个不同原子或原子团的碳原子为手性碳原子.
解答 解:(1)Mg2+含有10个电子,核外电子排布式为1s22s22p6,故答案为:1s22s22p6;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)BCl3分子的中心原子B的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,孤电子对数为0,因此空间构型和VSEPR模型一致,为平面正三角形,因此键角为120°,杂化类型为sp2杂化,
故答案为:平面正三角形;sp2;120°.
(4)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为: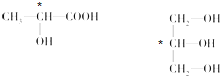 ,
,
故答案为: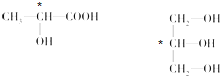 .
.
点评 本题考查了核外电子排布式(图)、配合物和分子结构,具有很强的综合性,难度中等,熟练掌握原子核外电子排布规律、价层电子对互斥理论和轨道杂化理论是解题的关键.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
18. 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.
Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
该反应的△H>0.(填“>”、“=”或“<”)
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).
 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).
15. 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下:
步骤1:在a中加入苯和少量铁屑,将b中液溴慢慢加入到a中,充分反应;
步骤2:反应结束后,冷却至常温过滤反应液;
步骤3:滤液用水洗后再用10%的NaOH溶液洗,得粗溴苯;
步骤4:向粗溴苯中加入少量无水氯化钙,静置、过滤.
回答下列问题:
(1)仪器a中铁屑的作用是催化剂,a中发生的主要反应方程式是 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
(2)仪器c的作用是冷凝回流.
(3)步骤3中用水洗涤除去的物质是FeBr3,后用NaOH溶液洗涤除去的物质是Br2.
(4)步骤4得到的粗溴苯中还含有杂质苯和少量对二溴苯等,下表是有关物质的物理性质数据,为了得到纯净的溴苯,还必须要进行的实验名称是蒸馏.
 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下:步骤1:在a中加入苯和少量铁屑,将b中液溴慢慢加入到a中,充分反应;
步骤2:反应结束后,冷却至常温过滤反应液;
步骤3:滤液用水洗后再用10%的NaOH溶液洗,得粗溴苯;
步骤4:向粗溴苯中加入少量无水氯化钙,静置、过滤.
回答下列问题:
(1)仪器a中铁屑的作用是催化剂,a中发生的主要反应方程式是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.(2)仪器c的作用是冷凝回流.
(3)步骤3中用水洗涤除去的物质是FeBr3,后用NaOH溶液洗涤除去的物质是Br2.
(4)步骤4得到的粗溴苯中还含有杂质苯和少量对二溴苯等,下表是有关物质的物理性质数据,为了得到纯净的溴苯,还必须要进行的实验名称是蒸馏.
| 苯 | 溴苯 | 对二溴苯 | |
| 密度/gcm-3 | 0.88 | 1.50 | 1.96 |
| 沸点/℃ | 80 | 156 | 220 |
| 水溶性 | 微溶 | 微溶 | 难溶 |
2.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
12.有关核外电子运动规律的描述错误的是( )
| A. | 核外电子质量很小,在原子核外绕核作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 在电子云示意图中,小黑点越密表示电子在核外空间单位体积内电子出现的概率越大 |
