题目内容
6.下列有关“电离平衡”的叙述中正确的是( )| A. | 电解质在溶液里达到电离平衡时,溶质电离出的离子浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 | |
| C. | 电离平衡时,弱电解质分子电离成离子的速率为零 | |
| D. | 电解质达到电离平衡后,各种离子的浓度不再变化 |
分析 A.电解质在溶液里达到电离平衡时,溶质电离出的离子浓度不一定相等;
B.电离平衡时,溶液中分子和离子浓度不再改变;
C.达到电离平衡时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,速率不为0;
D.电解质达到电离平衡后,分子的浓度和离子的浓度不再变化.
解答 解:A.电解质在溶液里达到电离平衡时,溶质电离出的离子浓度不一定相等,如:碳酸在水中电离出的离子有氢离子、碳酸根离子、碳酸氢根离子,碳酸电离出的离子浓度大小顺序是:c(H+)>c(HCO3-)>c(CO32-),故A错误;
B.电离平衡时,溶液中分子和离子浓度不再改变,但电离没有停止,只是弱电解质的电离和生成速率相等,所以说电离平衡是动态平衡,故B错误;
C.电离平衡是动态平衡,达到电离平衡后,电离速率与离子合成分子的速率相等,不是等于0,故C错误;
D.电解质达到电离平衡后,电离和离子结合成分子的速率相等,溶液中分子的浓度和离子的浓度不再变化,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡的判断,题目难度中等,注意掌握弱电解质的电离平衡实质,明确电离平衡为动态平衡,达到平衡状态时各离子、分子的浓度不再变化,不是为0.

练习册系列答案
相关题目
16. 中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
 中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时“X极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“Y极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水 |
17.将 转变为
转变为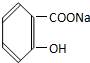 ,下列操作正确的是( )
,下列操作正确的是( )
 转变为
转变为 ,下列操作正确的是( )
,下列操作正确的是( )| A. | 与氢氧化钠共热后通足量的二氧化碳 | |
| B. | 溶解,加热通足量的二氧化硫气体 | |
| C. | 与稀硫酸共热后加足量氢氧化钠 | |
| D. | 与稀硫酸共热后加足量碳酸钠 |
1.下列化合物分子中一定既含σ键又含π键的是( )
| A. | C2H4 | B. | HClO | C. | NH3 | D. | H2O2 |
11.下列各组物质中,互为同位素的是( )
| A. | D2O和H2O | B. | 235U和238U | C. | O3和O2 | D. | SO3和SO2 |
16.将10mL 0.2mol/L CuSO4溶液与20mL 0.15mol/L Ba(OH)2溶液混合,反应后,溶液中离子浓度最大的是( )
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: