��Ŀ����
 pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10����mol��L��1����pC=��lg��1��10������=3��H2CO3��Һ��pC-pH��ϵ��ͼ��
pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10����mol��L��1����pC=��lg��1��10������=3��H2CO3��Һ��pC-pH��ϵ��ͼ��
��ش��������⣺
��1��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����Ϊ ��
��2����֪̼����Һ�д���ƽ��:H2O��CO2 H2CO3
H2CO3![]() H++HCO3��������ҺpH��5��С��0ʱ����Һ��H2CO3��pC���������ԭ����
H++HCO3��������ҺpH��5��С��0ʱ����Һ��H2CO3��pC���������ԭ����
��
��3���ܹ��ֿ�������������Ӱ�졢�������� pH�仯�������Һ����֮Ϊ������Һ����Ũ�Ⱦ�Ϊ0.1mol��L������NaHCO3��Na2CO3�����Һ����һ�ֻ�����Һ�����������������ƽ��HCO3�� H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ�����в����γɻ�����Һ���� ��
H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ�����в����γɻ�����Һ���� ��
A.̼���ƺ��������ƵĻ����Һ B.����ʹ����ƵĻ����Һ
C.����������ƵĻ����Һ D.��ˮ���Ȼ�淋Ļ����Һ
��1��H+��HCO3�� (2��)
��2����Һ��H+Ũ������ʱ��ƽ��H++HCO3��![]() H2CO3
H2CO3![]() H2O��CO2�����ƶ�������CO2�ܽ��С�����ɵ�CO2���ݳ�����H2CO3Ũ�Ȼ������䣨2�֣�
H2O��CO2�����ƶ�������CO2�ܽ��С�����ɵ�CO2���ݳ�����H2CO3Ũ�Ȼ������䣨2�֣�
��3��A��C (2��)

| A��ij�¶����κε���ʵ�ˮ��Һ�У�pC��H+��+pC��OH-��=14 | B��0.01mol/L��CaCl2��Һ���μӴ�����Һ���μӹ�����pC��Ca2+����С | C����0.01mol/L������ζ�ijŨ�ȵ�NaOH��Һ���ζ�������pC��H+�������� | D��ij�¶��£�AB���������ӻ������Ksp=1.0��10-10���䱥����Һ��pC��A+��+pC��B-��=10 |
 pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol/L������Һ�и����ʵ�pC=-lg10-3=3����֪H2CO3��Һ�д�������ƽ�⣺
pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol/L������Һ�и����ʵ�pC=-lg10-3=3����֪H2CO3��Һ�д�������ƽ�⣺ �������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
�������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
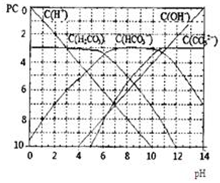 pC����pH����ָ��ϡ��Һ�У��������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ��1��10-3mol/L�������Һ�����ʵ�pC=-lg1��10-3=3��ͼΪH2CO3�ڼ���ǿ���ǿ����Һ��ƽ��ʱ��Һ�����ֳɷֵ�pC-pHͼ����ش��������⣺
pC����pH����ָ��ϡ��Һ�У��������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ��1��10-3mol/L�������Һ�����ʵ�pC=-lg1��10-3=3��ͼΪH2CO3�ڼ���ǿ���ǿ����Һ��ƽ��ʱ��Һ�����ֳɷֵ�pC-pHͼ����ش��������⣺