��Ŀ����
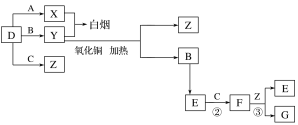
����Ŀ��ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲�����ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����
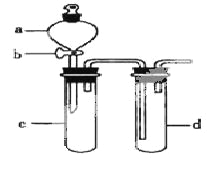
��1��ʵ��ǰ���رջ���b���Թ�d�м�ˮ����û�����ܿڣ������Թ�c��d�Ľ���������c����Ŀ����__________��
��2����d�м�����NaOH��Һ��c�з�һС��ͭƬ���ɷ�Һ©��a��c�м���2mLŨ���ᣬc�з�Ӧ�Ļ�ѧ����ʽ��______________________��
����a��c�м�2mL����ˮ��c�е�ʵ��������_____________��
��3���±�����ȡ����ͭ�����ַ�������������ɫ��ѧ�������ѷ�����_____��������_______��
���� | ��Ӧ�� |
�� | Cu��Ũ���� |
�� | Cu��ϡ���� |
�� | Cu��O2��ϡ���� |
��4����С��ͬѧ��d�м���KBr��Һ��c�м������KMnO4����a��c�м���Ũ���ᡣ�۲쵽��ʵ��������_________����С��ͬѧʵ��Ŀ����_________������ʵ��IJ���֮����_____________________��
���𰸡����װ�������� Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O ��Ӧ�仺��������ɫ�䵭 �� ���������٣�����Ⱦ c���л���ɫ���������d����Һ��Ϊ����ɫ ֤��������KMnO4��Cl2��Br2 û�д���β��
��������
��1����ʵ��ǰҪ���װ�������ԣ����Ǽ��װ�������Եij���������
��2����ͭ��Ũ���ᷴӦ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O����a��c�м�2mL����ˮ���������ϡ�ͣ���Ӧ��������Ϊ���������ܺ�ˮ��Ӧ��c��������ɫ��dz��
��3��ͭ��Ũ���ᷴӦ�������Ⱦ������NO2���壬�������������Ϊ�����ʵ�����1/2��ͭ��ϡ���ᷴӦ������Ի�����Ⱦ��NO����������ΪΪ�����ʵ�����3/4���ʱ���ͭ������������CuO������ϡ���ᷴӦ���Ի�������Ⱦ���Һ�����Ҫ�١�
��4�����������Һ��Ũ���ᷴӦ����Cl2��˵��������KMnO4ǿ��Cl2�����ò�����Cl2��KBr��Ӧ�õ�Br2����˵��Cl2��������ǿ��Br2����c���л���ɫ���������d����Һ��Ϊ����ɫ��ͬʱҪע��β�����ա�

����Ŀ����ϩ(C2H6)��ʯ�ͻ�����ҵ��Ҫ���л�ԭ��֮һ����Ҫ���������۱�ϩ�����ȱ��顢������Ȳ�Ʒ��
(1)���������Ʊ���ϩ����ͼ�ɵ�C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
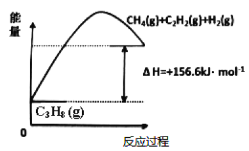
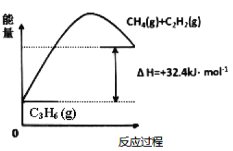
��Ϊ��ͬʱ��߷�Ӧ���ʺͷ�Ӧ���ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��
��Ŀǰ�ڱ��������Ʊ�ϩʱ��ͨ��������O2������ͬʱ�������з�Ӧ��2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol��ͨ��O2��Ŀ����_______��
(2)��C4H8��C2H4Ϊԭ�Ϸ���ϩ���绯��ӦC4H8(g)+C2H4(g)2C3H6(g) H>0
��ij�¶��£�������Ӧ�У�����Ӧ����Ϊv��=K��c(C4H8)c(C2H4)���淴Ӧ����Ϊv��=K��c2(C3H6)������K����K��Ϊ���ʳ������÷�Ӧʹ��WO3/SiO2Ϊ����������˵������ȷ����_____________
A.�����������绯��Ӧ�������ı䷴Ӧ����
B.����ʹK����K��������ͬ�ı���
C.����������ϩ���绯��Ӧ�Ļ�ܣ������˻���Ӱٷ���
D.���ʳ����Ĵ�С�뷴Ӧ�̶���ϵ
����֪t1minʱ�ﵽƽ��״̬����ô�ʱ������n(C4H8)=amol��n(C2H4)=2amol��n(C3H6)=bmol����ƽ��ʱC3H6���������Ϊ25%������������ͨ������ʵ�����C4H8��C2H4������ƽ����C3H6���������___________25%(����>������<������=��)��
(3)��ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�1,2-���ȱ���(CH2ClCHClCH3)����Ҫ������Ϊ3-�ȱ�ϩ(CH2=CHCH2Cl)����Ӧԭ��Ϊ��
��. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
һ���¶��£�������ܱ������г�������ʵ�����CH2=CHCH3(g)��Cl2(g)���ڴ��������·�����Ӧ���������������ѹǿ��ʱ��ı仯�����ʾ��
ʱ��/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
ѹǿ/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
���õ�λʱ���������ѹ�ı仯����ʾ��Ӧ���ʣ���![]() ����ǰ120min��ƽ����Ӧ����v(CH2ClCHClCH3)=____________kPamin-1��
����ǰ120min��ƽ����Ӧ����v(CH2ClCHClCH3)=____________kPamin-1��
�ڸ��¶��£���ƽ��ʱHCl���������Ϊ12.5%����Ӧ����ƽ�ⳣ��Kp=__________kPa-1(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��������С�����2λ)��