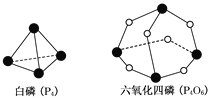
题目内容
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原予的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:
(1) A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为_________(用元素符号表示)。
(2) A与HF相比,其熔、沸点较低,原因是___________。
(3) B分子属于________(填“极性”或“非极性”)分子。
(4) D分子中心原子的杂化方式是________,由该原子组成的单质分子中包含________个π键,与该单质分子互为等电子体的常见分子的分子式为________。
(5) [Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请画出[Fe(NO)(H2O)5]2+结构示意图:___。
【答案】N>O>Cl>S HF分子间形成氢键 极性 sp3 2 CO 
【解析】
常见的18电子的二元化合物有:HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6;D可作为火箭推进剂的燃料,且原子个数为6,原子个数比为1:2,应为N2H4;A、C分子中两种原子的个数比均为1:1,A含有2个原子则A应为HCl,C含有4个原子,则C应为H2O2;B含有3个原子,个数比为1:2,应为 H2S。
(1)A、B、C、D分子中相对原子质量较大的四种元素分别为Cl、S、O、N,同周期元素自左至右第一电离能呈增大趋势,但N原子核外2p能级半满,更稳定,所以第一电离能大于O;同主族元素自上而下第一电离能减小,所以四种元素第一电离能由大到小排列顺序为N>O>Cl>S;
(2)由于HF分子间存在氢键,所以HF的沸点高于HCl;
(3)B为H2S,分子为V形,正负电荷中心不重合,为极性分子;
(4)D为N2H4,中心N原子与两个H原子形成2个σ键,与另一个N原子形成1个σ键,还有一对孤电子对,所以价层电子对数为4,为sp3杂化;N原子组成的单质为N2,分子中含一个氮氮三键,其中有2个π键;原子总数相同,价电子总数也相同的分子、离子或基团互为等电子体,所以与N2互为等电子的分子为CO;
(5)[Fe(NO)(H2O)5]2+中NO以N原子与Fe2+形成配位键,水分子中O原子含有孤电子对,所以H2O以O原子与Fe2+形成配位键,[Fe(NO)(H2O)5]2+的结构示意图为 ;
;