题目内容
(2013?烟台模拟)【化学--化学与技术】
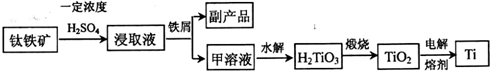
钛铁矿常用于冶炼金属钛,其主要成分为FeTiO3,含有FeO、Fe2O3等杂质.
(1)浸取液加足量铁屑充分反应后过滤,浓缩滤液冷却至273K,可结晶得到副产品
(2)甲溶液主要成分是Ti(SO4)2和TiOSO4.TiOSO4是Ti(SO4)2第一步水解的产物,其反应原理为
(3)已知TiO2熔融状态下不发生电离,电解时阴极反应式为
(4)钛在高温下与氧、碳、氮等元素结合能力极强.下列说法正确的是
a.冶炼金属钛时一定要隔绝空气和水
b.冶炼时可以使用耐高温的氧化铝坩埚
c.可用焦炭作还原剂制取高纯度的金属钛
d.炼钢时可加入金属钛避免氮气溶于钢水形成气泡.

钛铁矿常用于冶炼金属钛,其主要成分为FeTiO3,含有FeO、Fe2O3等杂质.
(1)浸取液加足量铁屑充分反应后过滤,浓缩滤液冷却至273K,可结晶得到副产品
FeSO4?7H2O
FeSO4?7H2O
(填化学式).常用乙醇洗涤该晶体,优点是利用乙醇的挥发,除去晶体表面附着的水分,减少晶体的损失
利用乙醇的挥发,除去晶体表面附着的水分,减少晶体的损失
.(2)甲溶液主要成分是Ti(SO4)2和TiOSO4.TiOSO4是Ti(SO4)2第一步水解的产物,其反应原理为
Ti(SO4)2+H2O TiOSO4+H2SO4
TiOSO4+H2SO4
 TiOSO4+H2SO4
TiOSO4+H2SO4Ti(SO4)2+H2O TiOSO4+H2SO4
TiOSO4+H2SO4
. TiOSO4+H2SO4
TiOSO4+H2SO4(3)已知TiO2熔融状态下不发生电离,电解时阴极反应式为
TiO2+4e-=Ti+2O2-
TiO2+4e-=Ti+2O2-
.(4)钛在高温下与氧、碳、氮等元素结合能力极强.下列说法正确的是
ad.
ad.
.a.冶炼金属钛时一定要隔绝空气和水
b.冶炼时可以使用耐高温的氧化铝坩埚
c.可用焦炭作还原剂制取高纯度的金属钛
d.炼钢时可加入金属钛避免氮气溶于钢水形成气泡.
分析:(1)加入铁粉可将Fe3+还原成Fe2+,过滤后滤液中含有FeSO4;根据晶体表面附着水分,FeSO4不溶于酒精,利用乙醇的挥发,除去晶体表面附着的水分,减少FeSO4的损失.
(2)根据题目信息可知反应物为:Ti(SO4)2和水,生成物为:TiOSO4和H2SO4;
(3)阴极上得电子反应还原反应生成金属钛;
(4)根据钛在高温下与氧、碳、氮等元素结合能力极强来分析;
(2)根据题目信息可知反应物为:Ti(SO4)2和水,生成物为:TiOSO4和H2SO4;
(3)阴极上得电子反应还原反应生成金属钛;
(4)根据钛在高温下与氧、碳、氮等元素结合能力极强来分析;
解答:解:(1)过滤后滤液中含有FeSO4,结晶后可得到FeSO4?7H2O晶体,故答案为:FeSO4?7H2O;FeSO4不溶于酒精,利用乙醇的挥发,除去晶体表面附着的水分,减少FeSO4的损失,故答案为:利用乙醇的挥发,除去晶体表面附着的水分,减少晶体的损失.
(2)反应物为:Ti(SO4)2和水,生成物为:TiOSO4和H2SO4,反应方程式为:Ti(SO4)2+H2O?TiOSO4+H2SO4;故答案为:Ti(SO4)2+H2O?TiOSO4+H2SO4;
(3)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-.
故答案为:TiO2+4e-=Ti+2O2-;
(4)a.金属钛能与氧气和水反应,所以冶炼金属钛时一定要隔绝空气和水,故a正确;
b.金属钛能与氧化铝反应,故不能用氧化铝坩埚,故b错误;
c.焦炭作还原剂与钛能TiO2反应生成Ti与一氧化碳,Ti能与一氧化碳反应,所以不可用焦炭作还原剂制取高纯度的金属钛,故c错误;
d.炼钢时可加入金属钛,钛能与氮气反应,避免氮气溶于钢水形成气泡,故d正确;
故选:ad;
(2)反应物为:Ti(SO4)2和水,生成物为:TiOSO4和H2SO4,反应方程式为:Ti(SO4)2+H2O?TiOSO4+H2SO4;故答案为:Ti(SO4)2+H2O?TiOSO4+H2SO4;
(3)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-.
故答案为:TiO2+4e-=Ti+2O2-;
(4)a.金属钛能与氧气和水反应,所以冶炼金属钛时一定要隔绝空气和水,故a正确;
b.金属钛能与氧化铝反应,故不能用氧化铝坩埚,故b错误;
c.焦炭作还原剂与钛能TiO2反应生成Ti与一氧化碳,Ti能与一氧化碳反应,所以不可用焦炭作还原剂制取高纯度的金属钛,故c错误;
d.炼钢时可加入金属钛,钛能与氮气反应,避免氮气溶于钢水形成气泡,故d正确;
故选:ad;
点评:本题结合金属的冶炼,考查了实验原理、物质的性质、电极反应式的书写等知识点,难度不大.

练习册系列答案
相关题目