题目内容
在一定温度下,1mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子为( )
| A、2mol | B、3mol | C、4mol | D、5mol |
分析:反应中硝酸起氧化剂与酸性作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2,根据电子转移守恒可知铜失去的电子转移给硝酸生成NO2和NO,所以反应过程中转移的电子为铜失去的电子,据此分析解答.
解答:解:反应中硝酸起氧化剂与酸性作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2,由Cu原子守恒可知,n[Cu(NO3)2]=n(Cu)=1mol,根据氧化还原反应电子转移守恒可知:铜失去的电子转移给硝酸生成NO2和NO,所以反应过程中转移的电子为铜失去的电子,铜从0价变为+2价,失去2e-,所以1mol铜失去2mol电子,则反应过程中转移的电子为2mol,
故选A.
故选A.
点评:本题考查氧化还原反应计算,难度不大,利用电子转移守恒与元素守恒计算是关键,注意守恒思想在氧化还原反应计算中的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
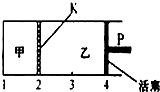 已知可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
已知可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A、保持乙中压强不变,升高温度,达到新的平衡后,乙中平均相对分子质量增大 | B、保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,一定有c(B)乙>c(B)甲 | C、若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7% | D、保持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙 |
 (2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
(2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )