题目内容
B
解析试题分析:A当可能反应达到平衡后无论时间如何变化,CO2与CO的物质的量之比不变。错误。B. 升高反应温度,无论是正反应速率还是逆反应速率都加快。正确。C.可逆反应的化学平衡常数只跟温度有关,而与压强无关。错误。D. MgSO4是固体,无论它的质量如何变化,CO的转化率都不变。错误。
考点:考查反应物的转化率、化学平衡常数及各物质的质量比与外界条件的关系的知识。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
升高温度,下列数据不一定增大的是
A.化学反应速率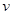 | B.KNO3的溶解度S |
| C.化学平衡常数K | D.水的离子积常数Kw |
已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
| 组号 | 反应温 度/℃ | Na2S2O3 | H2SO4 | H2O体积/mL | ||
| 体积/mL | 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | |||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
下列实验事实能用平衡移动原理解释的是
A. |
B. |
C. |
D. |
某温度下,已知反应mX(g)+nY(g) 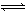 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
两体积的密闭容器中均充入1mol X和1mol Y,分别用于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在 时刻改变了某一实验条件。下列判断正确的是
时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 | B.正反应是吸热反应 |
C. 时刻可能是增大了压强 时刻可能是增大了压强 | D. 时刻可能是降低了温度 时刻可能是降低了温度 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
| A.v(A2)=0.8mol·L-1·s-1 | B.v(A2)=40mol·L-1·min-1 |
| C.v(AB3)=1.0mol·L-1·s-1 | D.v(B2)=1.2mol·L-1·s-1 |
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H>0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是