题目内容
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: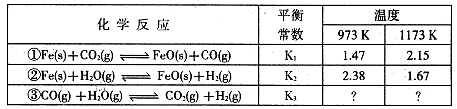
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: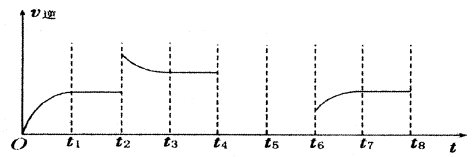
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。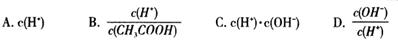
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
Ⅰ
(1)吸热
K2
①升高温度或增大CO2的浓度(增大H2的浓度)
②
Ⅱ、(1)3
(2)BD
(3) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
解析试题分析:Ⅰ(1)升高温度,平衡常数增大,正反应是吸热反应。
K3= 而K1=
而K1= ,K2=
,K2= 故K3=K2X
故K3=K2X
(3)?升高温度或增大CO2的浓度(增大H2的浓度)
Ⅱ、(1)根据c(H+)=c(HAc)ɑ,则c(H+)=0.1X1%,PH=3
电离常数不变,c(H+)在稀释过程中总体是减小的;水的离子积常数不变;c(H+)减小,则c(OH-)增大,故选BD。
(3)据题意,混合溶液的PH为5.6,溶液显弱酸性,则有 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
考点:化学平衡和电离平衡。考察化学平衡的影响因素以及电离平衡的影响因素。

某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
甲醇是一种很好的燃料,工业上用CH4和H2O 为原料,通过反应I和Ⅱ来制备甲醇。
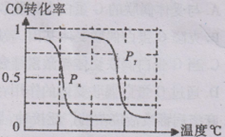
⑴将1.0 mol CH4和2.0 mol H2O(g)通人反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1_ P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0 ……Ⅱ
CH3OH(g) △H<0 ……Ⅱ
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充人He,使体系总压强增大 D.再充人lmol CO和3 mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.下表中剩余的实验条件数据: a=_ ;b=_ 。
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。

(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为 。

(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。


①常温下,pH=6→7时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
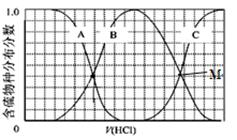
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
 CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。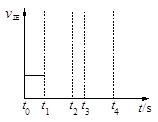
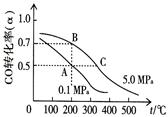

 H2(g) +CO2(g)平衡常数K随温度的变化如下表:
H2(g) +CO2(g)平衡常数K随温度的变化如下表:
 2C0 Cg)平衡常数K1;
2C0 Cg)平衡常数K1; CO Cg) +H2(g)平衡常数K2
CO Cg) +H2(g)平衡常数K2

 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。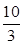 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol