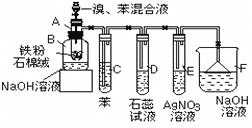
��Ŀ����
����Ŀ����������������Ӧ����㷺�����������ͺ����²��ϵ�Ӧ�ñ��ܹ�ע��
(1)��¯������ұ��������Ҫ��������������Ҫ��Ӧ��:
��Ӧ | ��H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
�Լ��㣬X=_____��K1��K2��K3֮��Ĺ�ϵΪK1=__________��
(2)T1��ʱ,��ij�����ܱ������м���һ������Fe2O3��C��������Ӧi����Ӧ�ﵽƽ�����t1ʱ��,�ı�ij����,V(��)��ʱ��(t)�ı仯��ϵ��ͼ1��ʾ����t1ʱ�̸ı������������_____(��д��ĸ)��
a.�����¶Ȳ���,ѹ������ b.����������䣬�����¶�
c.�����������,������̼�� d.�����������,����COŨ��
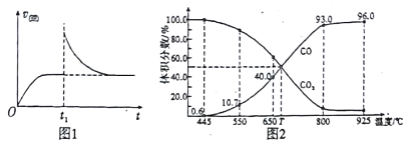
(3)��һ���¶��£���ij����ɱ�ĺ�ѹ�ܱ�����(p��)����1molCO2 ��������̼��������Ӧ����ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ2 ��ʾ��
��650��ʱ,�÷�Ӧ��ƽ������յ�������_________��
��T��ʱ,����ƽ����ϵ���ٳ���һ������V(CO2):V(CO) =5:4�Ļ�����壬ƽ��_____(� ������ ���� ���� )�ƶ���
��925��ʱ,��ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KpΪ_____��[�����ѹ(p��)=������ѹ(p��) �������������ij���ʵ�ƽ���ѹ�������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp]
(4)��ԭ���ԭ�����Գ�ȥ���Է�ˮ�е�������ϩ��AsO3-����ԭ������ͼ��ʾ( ������ڲ�Ϊ���������)��
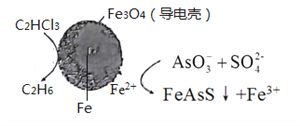
�ڳ��۹����У�����������е�FeΪԭ��ص�______�� (���"����)��д��C2HCl3������汻��ԭΪ����ĵ缫��ӦʽΪ_____________��
���𰸡�-27 K2K33 ad 43kJ ���� 23.04P�� �� C2HCl3 +5H++8e-=C2H6 +3Cl-
��������
��֪��i. Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g) ��H=+489 kJ/mol��K1=c3(CO)��iii. C(s)+CO2(g)
2Fe(s)+3CO(g) ��H=+489 kJ/mol��K1=c3(CO)��iii. C(s)+CO2(g) ![]() 2CO(g) ��H=+172 kJ/mol��K3= c2(CO)/C(CO2)����i- iii
2CO(g) ��H=+172 kJ/mol��K3= c2(CO)/C(CO2)����i- iii![]() 3�ã�Fe2O3(s)+3CO(g)
3�ã�Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H=+489-172
2Fe(s)+3CO2(g) ��H=+489-172![]() 3=-27 kJ/mol;K2= c3(CO2)/ c3(CO)��K2. K33=[c3(CO2)/ c3(CO)] [c2(CO)/C(CO2)]3= c3(CO)=K1���𰸣� -27 K2K33
3=-27 kJ/mol;K2= c3(CO2)/ c3(CO)��K2. K33=[c3(CO2)/ c3(CO)] [c2(CO)/C(CO2)]3= c3(CO)=K1���𰸣� -27 K2K33
�� Fe2O3(s)+3C(s) ![]() 2Fe(s)+3CO(g) ��H=+489 kJ/mol��ͼ1�淴Ӧ����Ѹ�������淴Ӧ����a.�����¶Ȳ���,ѹ������,�൱������CO��Ũ�ȣ������淴ӦѸ������������a�������⣻b.����������䣬�����¶�ƽ�������ƶ������淴Ӧ���ʶ�����ѧƽ�ⳣ���������b���������⣻c.�����������,������̼�ۣ���Ϊ̼���ǹ��壬�ı���������Ӱ�컯ѧƽ���ƶ�������c���������⣻d.�����������,����COŨ�ȣ�����������Ũ�ȣ����淴Ӧ���ʶ������淴Ӧ�������ӵ����ʸ��죬���¶�û�䣬��ѧƽ�ⳣ�����䣬����d�������⣻�𰸣�.ad��
2Fe(s)+3CO(g) ��H=+489 kJ/mol��ͼ1�淴Ӧ����Ѹ�������淴Ӧ����a.�����¶Ȳ���,ѹ������,�൱������CO��Ũ�ȣ������淴ӦѸ������������a�������⣻b.����������䣬�����¶�ƽ�������ƶ������淴Ӧ���ʶ�����ѧƽ�ⳣ���������b���������⣻c.�����������,������̼�ۣ���Ϊ̼���ǹ��壬�ı���������Ӱ�컯ѧƽ���ƶ�������c���������⣻d.�����������,����COŨ�ȣ�����������Ũ�ȣ����淴Ӧ���ʶ������淴Ӧ�������ӵ����ʸ��죬���¶�û�䣬��ѧƽ�ⳣ�����䣬����d�������⣻�𰸣�.ad��
(3) ����ͼ2��֪��650��ʱ��Ӧ��ƽ���CO���������Ϊ40![]() �����ݻ�ѧƽ������ʽ�ɣ�
�����ݻ�ѧƽ������ʽ�ɣ�
C(s)+CO2(g) ![]() 2CO(g) ��H=+172 kJ/mol
2CO(g) ��H=+172 kJ/mol
��ʼ�� (mol) 1 0
�仯����mol�� x 2x
ƽ������mol�� 1-x 2x
�� [2x/(1-x+2x)]![]() 100
100![]() =40
=40![]() ,x=0.25mol�������Ȼ�ѧ��Ӧ����ʽ֪�÷�Ӧ�ﵽƽ��ʱ���յ�����Ϊ0.25mol
,x=0.25mol�������Ȼ�ѧ��Ӧ����ʽ֪�÷�Ӧ�ﵽƽ��ʱ���յ�����Ϊ0.25mol![]() 172 kJ/mol=43kJ���𰸣�43kJ��
172 kJ/mol=43kJ���𰸣�43kJ��
��T��ʱ,����ƽ����ϵ���ٳ���һ������V(CO2):V(CO) =5:4�Ļ�����壬��ԭƽ��ʱV(CO2):V(CO) =1:1���簴V(CO2):V(CO) =5:4�൱��������c(CO2)Ũ�ȣ���ѧƽ�������ƶ����𰸣�������
��925��ʱ,CO���������Ϊ96![]() ����CO2���������Ϊ4
����CO2���������Ϊ4![]() ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=��96
����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=��96![]() P����2/(4
P����2/(4![]() P��)=23.04P�����𰸣�23.04P��
P��)=23.04P�����𰸣�23.04P��
��4����ͼ3֪�����������Feʧ������������C2HCl3������汻��ԭΪ���飬���ݵ���غ�͵����غ㣬�õ缫��ӦʽΪC2