题目内容
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【答案】C
【解析】
A.CO的物质的量的变化为(2.00-0.80)mol,反应在t1min内的平均速率为v(CO)=(2.00-0.80)mol ÷2L÷t1min =(0.60/t1)mol·L-1·min-1,根据反应速率之比等于化学计量数之比,t1min内H2的平均反应速率与CO的平均反应速率相同,故A正确;
B.根据t2>t1,对比表中数据可知t1 min时已经达到平衡状态,而反应物和生成物的化学计量数都为1,则其它条件不变,起始时向容器中充入的3.00 molCO和2.00 molH2O(g)与充入2.00molCO和3.00molH2O(g)达平衡时,反应的限度相同,故达到平衡时,n(CO2)=1.20 mol,故B正确;
C.增大反应物CO的浓度,平衡正向移动,CO转化率减小,水蒸气的转化率增大,故C错误;
D.T1℃时,该反应的平衡常数为K=(1.2/2)×(1.20/2)÷(0.80/2)×(1.80/2)=1,T2℃,上述反应的平衡常数为0.70,温度升高,平衡常数减小,平衡逆向移动,说明正反应为放热反应,故D正确。
故选C。

【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
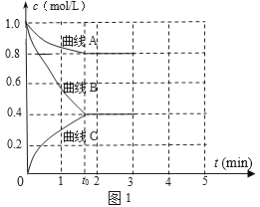
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
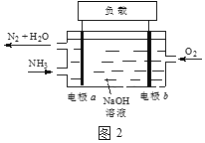
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。