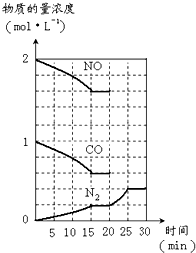
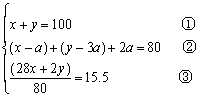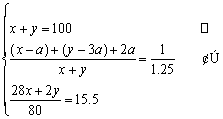题目内容
在一定温度下,将100mL氮氢混合气充入密闭恒压容器中,反应平衡时,维持温度不变,测得混合气的密度是反应前的1.25倍,平均相对分子质量为15.5,求平衡时N2的转化率为a(N2)?氮氢两种气体开始各多少毫升?
答案:
解析:
解析:
| 解:解法一:根据密闭容器中混合气的质量始终不变,求平衡时体积为多少毫升。
设起始密度d,平衡时混合气体体积V(mL)。 则100d=1.25dV,∴ V=80 (2)没起始N2为xmL,H2为ymL,N2反应为amL。 则 N2 + 3H2ƒ2NH3 x y 0 a 3a 2a (x-a) (y-3a) 2a 依题意, ∴ x=40,y=60,a=10,a(N2)= 解法二:根据同温同压,密闭容器内气体的密度与体积成反比,其实还是气体质量不变。因而解法一又可按下式列方程。
∴ x=40,y=60,a=10,a(N2)=25%
|

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目