题目内容
下列说法正确的是
| A.在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大 |
| B.pH=0的溶液是酸性最强的溶液 |
| C.强酸的水溶液中不存在OH- |
| D.某温度下,纯水中c(H+)=2×10-7mol·L-1,其呈酸性 |
A
解析试题分析:A、由于在溶液中氢离子浓度与OH-浓度之积为常数,因此在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大,A正确;B、pH=0的溶液中氢离子浓度是1mol/L,并不是酸性最强的溶液,B不正确;C、任何水溶液中都存在氢离子和OH-,所以强酸的水溶液中一定存在OH-,C不正确;D、任何温度下纯水都是显中性的,D不正确,答案选A。
考点:考查水的电离、溶液酸碱性的判断

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列过程或现象与盐类水解无关的是
| A.草木灰不能与铵混合使用态氮肥 |
| B.铁在潮湿的环境下生锈 |
| C.加热氯化铁溶液颜色变深 |
| D.浓硫化钠溶液有臭味 |
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为
| A.1∶1011 | B.1∶103 | C.1∶108 | D.108∶1 |
下列化学用语表示的几种微粒中能影响水的电离平衡,且能使水的电离平衡向右移动的是
| A.HSO4- | B.Cl- | C.aX+ | D.bX2- |
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
| A.②③④① | B.②①③④ | C.③②④① | D.③②①④ |
运用电离常数判断可以发生的反应是
| 酸 | 电离常数(25oC) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO
测定CuSO4?nH2O的结晶水含量,方法是:称量样品→ 在坩埚中加热→ 冷却→ 称量无水盐。若用相同方法测试下列晶体中的结晶水含量,可行的是
| A.Cu(NO3)2?nH2O | B.MgCl2?nH2O | C.MgSO4?nH2O | D.FeSO4?nH2O |
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A. | B. | C.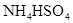 | D. |