题目内容
合成氨对化学工业和国防工业具有重要意义.
(1)写出工业上合成氨的化学方程式________.
(2)下图为不同温度时平衡混合物中氨的体积分数分别与时间(t)和压强(P)的关系.


其中T=500℃,温度为450℃对应的曲线是________(选“a”或“b”).
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
一定温度下,在2 L容器中发生上述反应,各物质的投料及物质的量变化如下表:

①析表中数据,判断5-7 min之间反应是否处于平衡状态________(填“是”或“否”),前5 min平均反应速率v(CH4)=________.
②反应在7~10 min之间,CO的物质的量减少的原因可能是________(填字母).
a.减少CH4
b.降低温度
c.增大压强
d.充入H2
③若保持温度不变,向1 L容器中充入0.15 mol CH4、0.45 mol H2O、________mol CO、________mol H2,达到平衡时CH4的体积分数与第一次投料相同.
答案:

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: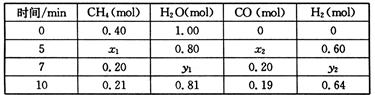
 CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: