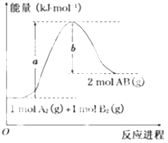
题目内容
【题目】处理生活污水中的NH4+ , 过程如下: 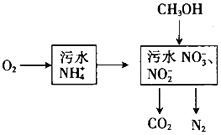
(1)空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
(2)根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 . 此方法的优点是
(3)完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[以n(O2)与n(CH3OH)表示].
【答案】
(1)减小
(2)N2;不消耗甲醇等还原剂,减少原材料
(3)4n(O2)=3+6n(CH3OH)
【解析】解:(1)空气将NH4+转变为NO3﹣(或NO2﹣)的反应为:NH4++2O2=NO3﹣+2H++H2O,酸性增强,pH减小;所以答案是:减小;(2)NO2﹣的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气,此方法的优点是不消耗甲醇等还原剂,减少原材料,
所以答案是:N2;不消耗甲醇等还原剂,减少原材料; (3)处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒可知:4n(O2)=3+6n(CH3OH),
所以答案是:4 n(O2)=3+6n(CH3OH).

练习册系列答案
相关题目