题目内容
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.25 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)推测在同周期或同主族的元素中x值与原子半径的关系是________。根据短周期元素的x值变化特点,体现了元素性质的________变化规律。
(2)通过分析x值变化规律,确定Mg、N的x值范围:________<x(Mg)<________,________<x(N)<________。
(3)在P-N键中,共用电子对偏向________原子;
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Dx)即Dx>1.7时,一般为离子键,Dx<1.7,一般为共价键,试推断:AlBr3中化学键类型是________。
(5)推测元素周期表中,x值最大的元素是________。
答案:
解析:
提示:
解析:
(1)原子半径越小,x值越大,周期性;(2)0.93,1.57,2.25,3.44;(3)氮(N)
(4)共价键;(5)氟(F)
提示:
从表中可看出同周期的元素随着原子序数的增大吸电子能力逐渐增强,越容易带负电,x值越大;而同主族的元素随着原序数的增大吸电子能力增强,x值越大。

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目

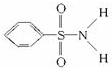 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向