题目内容
一种由甲醇和氧气以及强碱作为电解质溶液的新型手机电池,其电池反应为:
2CH3OH + 3O2 + 4OH- 2 CO32— + 6H2O,则下列说法错误的是
2 CO32— + 6H2O,则下列说法错误的是
2CH3OH + 3O2 + 4OH-
 2 CO32— + 6H2O,则下列说法错误的是
2 CO32— + 6H2O,则下列说法错误的是| A.充电时电解质溶液的pH逐渐增大 |
| B.放电时CH3OH参与反应的电极为正极 |
| C.充电时每生成1 mol CH3OH转移6 mol电子 |
| D.放电时负极的电极反应为:CH3OH-6e- +8OH- =CO32—+ 6H2O |
B
试题分析:A、充电时,相当于电解池的工作原理,根据总反应:2CH3OH+3O2+4OH-
 2CO32-+6H2O,生成大量的氢氧根离子,所以碱性增强,故电解质溶液的pH逐渐增大,故A正确;
2CO32-+6H2O,生成大量的氢氧根离子,所以碱性增强,故电解质溶液的pH逐渐增大,故A正确;B、放电时,相当于原电池的工作原理,负极发生失电子的氧化反应,根据总反应:2CH3OH+3O2+4OH-
 2CO32-+6H2O,则放电时CH3OH参与反应的电极为负极,故B错误;
2CO32-+6H2O,则放电时CH3OH参与反应的电极为负极,故B错误;C、充电时,根据总反应:2CH3OH+3O2+4OH-
 2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1mol
2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1molCH3OH转移6mol电子,故C正确;
D、放电时负极发生失电子的氧化反应,根据总反应:2CH3OH+3O2+4OH-
 2CO32-+6H2O,则负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故D正确。
2CO32-+6H2O,则负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故D正确。故选B。
点评:考查燃料电池的充放电时的电极反应判断及电极方程式的书写。可以根据所学知识进行回答,难度中。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目

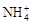 +2e-=Mn2O3+2NH3+H2O。
+2e-=Mn2O3+2NH3+H2O。
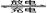 2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是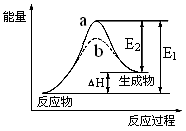
 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1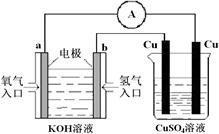
 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)