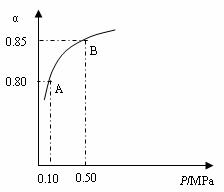
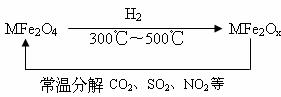
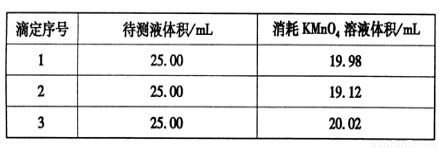
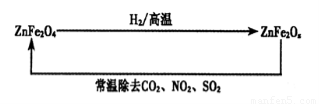
题目内容
为除去工业废气中的SO2,查得一份“将SO2转化为硫酸铵”的资料记录如下:“一个典型实例,初步处理后的废气含0.2%的SO2和10%的O2(体积含量),在400℃时,废气以5m3×h-1的速率通过V2O5催化剂层后与20L×h-1速度的NH3混合再喷水,此时温度由400℃降到200℃,在热的结晶装置中得到硫酸铵”。(气体体积均已折算为标准状况)仔细阅读上文,回答下列问题:
(1)按反应理论值,SO2和O2的物质的量之比为2∶1,该资料这个比值是多少?为什么?
(2)通过计算说明为什么废气以5m3×h-1的速度与20L×h-1速度的NH3混合。
答案:
解析:
解析:
解:(1)资料中给出废气含0.2%的SO2和10%的O2(体积分数),所以n(SO2)∶n(O2)=V(SO2)∶V(O2)=0.2%∶10%=2∶100,明显O2过量,增大O2的量有利于提高SO2的转化率。 (2)2SO2+O2 SO3+H2O══H2SO4 2NH3+H2SO4═(NH4)2SO4 ∴ 总反应为:2NH3+SO2+1/2O2+H2O═(NH4)2SO4 ∴ NH3与SO2的体积之比为2∶1时恰好反应。通SO2的速率为5m3×h-1´1000L×m-3´0.2%=10L×h-1,通NH3速率为20L×h-1与理论值刚好一致。
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 (2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.