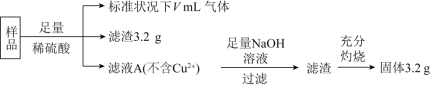题目内容
【题目】一定温度时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应:
,发生反应:![]() 经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列说法正确的是![]()
A.反应在前2s的平均速率![]()
B.保持其他条件不变,体积压缩到![]() ,平衡常数将增大
,平衡常数将增大
C.相同温度下,起始时向容器中充入![]() ,达到平衡时,
,达到平衡时,![]() 的转化率等于
的转化率等于![]()
D.保持温度不变,向该容器中再充入![]() 、
、![]() ,反应达到新平衡时
,反应达到新平衡时![]() 增大
增大
【答案】D
【解析】
A.根据表格中数据知,当n(SO3)=1.8mol,该反应达到平衡状态,反应在前2s的平均速率v(SO3)= =0.2mol·L-1·s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=
=0.2mol·L-1·s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=![]() ×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;
C.相同温度下,起始时向容器中充入4mol SO3,如果三氧化硫完全转化为二氧化硫和氧气,二氧化硫和氧气的物质的量分别是4mol、2mol,为原来的2倍,增大压强平衡正向移动,则二氧化硫转化率增大,所以二氧化硫转化率大于90%,相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率小于10%,故C错误;
D.温度不变,向该容器中再充入2mol SO2、1mol O2,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减小,所以比值增大,故D正确;
故选:D。

【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
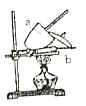
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。