题目内容
已知Ag+和Cl-反应生成AgCl,每次新生成的AgCl有10%见光分解为Ag和Cl2,氯气又可与水反应生成HClO3和HCl,而形成的Cl-与剩余的Ag+作用生成AgCl,这样循环往复直到最终.
(1)写出上述各步反应的化学方程式.
(2)现有含1.1mol NaCl的溶液,加入足量的AgNO3溶液,问最终能生成多少克的Ag和AgCl?若最后溶液体积为1升,问H+的物质的量浓度是多少?
解析:
|
(1)Ag++Cl- 2AgCl 3Cl2+3H2O (2)n(Cl-)=1.1mol, n(Ag)=6n(HClO3), n(Cl-)=n(AgCl)+n(HClO3)=1.1, n(AgCl)=9n(Ag), 解得:n(Ag)=0.12mol,n(AgCl)=1.08mol,n(HClO3)=0.02mol. 所以Ag的质量为0.12×108=12.96g,AgCl的质量为1.08×143.5=154.98g. n(H+)=n(Ag)=0.12mol, c(H+)= 【巧解导析】这是一道把多种守恒关系有机地融合在一起的好题,首先是得失电子守恒,化合价升高的只有Cl- |
提示:
|
【巧解点悟】本题中虽然反应多,但抓住反应物NaCl,AgNO3,H2O和生成物Ag,AgCl,HClO3,NaNO3之间的关系就不难看出,本题也可用总反应式法: 55NaCl+60AgNO3+3H2O 55 54 1.1 6Ag + HClO3+5HNO3 6 1 但若列出数列再找通项公式最后求和,相信就会大大增加解题时间,从而事倍功半. |

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案 AgCl↓
AgCl↓ 2Ag+Cl2
2Ag+Cl2 =0.12mol/L.
=0.12mol/L. HClO3,而化合价降低的只有Ag+
HClO3,而化合价降低的只有Ag+ Ag.所以n(Ag)=6n(HClO3).其次是质量守恒n(Cl-)=n(AgCl)+n(HClO3)(氯元素原子个数守恒).最后是题给微粒关系,每次AgCl均有10%分解,n(AgCl)=9n(Ag).有了上述分析解题就容易多了.
Ag.所以n(Ag)=6n(HClO3).其次是质量守恒n(Cl-)=n(AgCl)+n(HClO3)(氯元素原子个数守恒).最后是题给微粒关系,每次AgCl均有10%分解,n(AgCl)=9n(Ag).有了上述分析解题就容易多了. =1.08
=1.08 =0.12
=0.12  =0.02
=0.02 .(已知:
.(已知: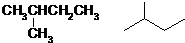 )
)
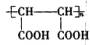
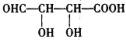 或
或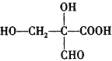
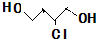
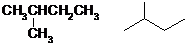
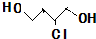 .(已知:
.(已知: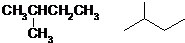 )
)