题目内容
5.有毒物质的无害化也是绿色化学研究的内容之一.ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO${\;}_{2}^{-}$和CN-等有毒有害的还原性离子氧化而除去.请写出用ClO2将废水中含有剧毒的CN-氧化成无毒气体的离子方程式:2ClO2+2CN-=2CO2↑+N2↑+2Cl-,该方法的优点是产物为无毒的气体(CO2和N2).分析 用ClO2将废水中含有剧毒的CN-氧化成无毒气体,反应生成二氧化碳、氮气和氯离子,以此来解答.
解答 解:用ClO2将废水中含有剧毒的CN-氧化成无毒气体,反应生成二氧化碳、氮气和氯离子,离子反应为2ClO2+2CN-=2CO2↑+N2↑+2Cl-,该方法的优点是产物为无毒的气体(CO2和N2),故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;产物为无毒的气体(CO2和N2).
点评 本题考查物质的性质及离子反应,为高频考点,把握习题中的信息及发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
13.在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子.含有手性碳原子的分子一般是手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是( )
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3CH(OH)COOH |
17.下列关于实验室制取氯气的操作正确( )
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
①用药匙向烧瓶中加入浓盐酸,再向分液漏斗中装入MnO2粉末;②用酒精灯直接加热烧瓶;
③需检查装置的气密性;④多余氯气用NaOH溶液吸收;⑤可用装有碱石灰的干燥管干燥氯气.
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
3.某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为CuSO4、Cu(NO3)2,剩余固体总质量为2.24 g
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
| 实验示意图 | 实验现象 | 解释 |
甲: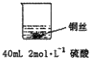 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
4.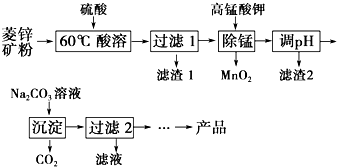 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
(1)ZnCO3酸溶时的离子方程式为ZnCO3+2H+═Zn2++H2O+CO2↑.
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
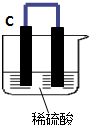 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中. 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.