题目内容
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________.
(2)B为0.1 mol·L-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):________;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:
________.(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
________,目的是________;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
________.(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) Ag+(aq)+Cl-(aq)在25℃时,氯化银的Ksp=1.8×10-10
Ag+(aq)+Cl-(aq)在25℃时,氯化银的Ksp=1.8×10-10
25℃时现将足量氯化银分别放入①100 mL蒸馏水中②100 mL 0.2 mol·L-1 AgNO3溶液中③100 mL 0.1 mol·L-1氯化铝溶液中④100 mL 0.1 mol·L-1盐酸溶液中.充分搅抖后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为________mol·L-1.
解析:
|
(1)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分) (2)HCO3- HCO3-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性.(2分) (3)盐酸(1分) 抑制Fe3+水解(2分) Fe3++3HCO3- (4)②①④③(2分) 9×10-10(2分) |

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
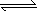 H++CO32、HCO3+H2O
H++CO32、HCO3+H2O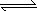 H2CO3+OH-、H2O
H2CO3+OH-、H2O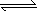 H++OH;(3分)
H++OH;(3分) Fe(OH)3↓+3CO2↑(2分)
Fe(OH)3↓+3CO2↑(2分)