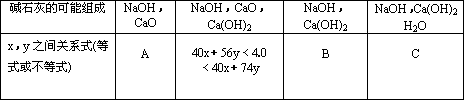题目内容
| |||||||||||
解析:
(1) |
①A,n(Na+)=n(OH-)-2n(Ca2+)(2分) ②40x+56y=4.0;40x+74y=4.0;40x+74y<4.0 |
(2) |
NaOH%=13%,Ca(OH)2=72%,H2O=15% |

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案(10分)中学化学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。试根据题目的要求,回答下列问题:
(1)这种碱石灰中,除NaOH外还可能含有的物质是(可填满、可不填满也可补充)
情况1 | 情况2 | 情况3 | 情况4 | 情况5 |
|
|
|
|
|
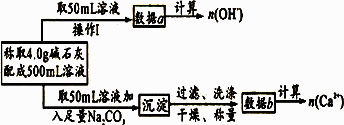
(2)为探究这种碱石灰的组成,某校研究性学习小组(甲)设计的思路是:称取4.0g碱石灰配成500mL溶液,用pH计测溶液的pH,然后再通过 (填实验方法)测 (填物理量名称)即可推算出其组成的成分。
(3)研究性学习小组(乙)查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取该法制得的碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。
(4)为使该法制得的碱石灰所起的效果更好,除控制好NaOH与CaO的配比外,还需控制的实验条件是什么?