题目内容
19.下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是( )| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.锌和硫酸铜反应生成铜,铜、锌和稀硫酸构成原电池,作原电池负极的金属加速被腐蚀;
B.原电池中,在电解质溶液里易失电子的物质作负极;
C.石墨是能导电的非金属单质,稳定性和导电性都好;
D.MgCl2是离子化合物,电解MgCl2的饱和溶液得到氢氧化镁.
解答 解:A.锌和硫酸铜反应生成铜,铜、锌和稀硫酸构成原电池,作原电池负极的锌加速被腐蚀,所以生成氢气的反应速率增大,有因果关系,故A错误;
B.该装置能自发的进行氧化还原反应,符合原电池的构成条件,所以能构成原电池,铝在碱性条件下易失电子而作负极,镁作正极,故B错误;
C.石墨性质较稳定,且导电性好,所以常常作电解池的电极材料,故C正确;
D.MgCl2是离子化合物,电解MgCl2的饱和溶液得到氢氧化镁,得不到镁,故D错误;
故选C.
点评 本题考查了原电池原理、化合物类型的判断、金属的冶炼等知识点,根据金属的活泼性确定冶炼方法,原电池中作负极的金属易被腐蚀.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
9.下列各种比较中,正确的是( )
| A. | 元素电负性:Ti<Ga | |
| B. | 第二电离能(I2):Na>Mg | |
| C. | 金属晶体的晶胞中空间利用率:体心立方堆积>面心立方堆积. | |
| D. | 晶格能:NaCl>MgO |
10.香烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4,②澄清石灰水,③加热CuO,④生石灰,⑤品红溶液,⑥KMnO4酸性溶液等药品可将其一一检出,检测香烟烟雾通入药品的正确顺序是( )
| A. | ①-⑤-②-①-④-③ | B. | ①-⑤-⑥-②-④-③ | C. | ③-④-②-⑥-⑤-① | D. | ②-⑤-①-④-③-⑥ |
7.有机物阿魏酸的化学式为C10H10O4.符合下列条件的阿魏酸的同分异构体有( )
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
14.下列关于甲烷的叙述中错误的是( )
| A. | 甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
4.实验设计和判断.为了研究过氧化氢分解速率,请回答下列问题.
(1)填写实验报告(填写空白处)
(2)过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
(1)填写实验报告(填写空白处)
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
11.将1mol 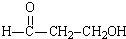 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
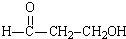 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
8.下列分子中所有原子都处于同一平面上的是( )
| A. | CH4、丙烯、丙炔 | B. | 乙烯、乙炔、苯 | ||
| C. | 1,3-丁二烯、C6H5-CH3、环己烷 | D. | 丙烯、乙炔、CH3CH3 |
9.元素周期表可以划分为5个区,下列有关说法正确的是( )
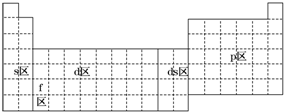

| A. | s区全部是金属元素 | |
| B. | p区全部是非金属元素 | |
| C. | d区内元素原子的价电子排布必为(n-1)d1~10ns2 | |
| D. | 除ds区外,以最后填入电子的轨道能级符号作为区的符号 |