题目内容
3.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )| A. | Na+ | B. | NO3- | C. | Mg2+ | D. | OH- |
分析 先根据电荷守恒判断M离子所带电荷情况,然后根据离子能否大量共存判断可能存在的离子.
解答 解:经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M应该带有负电荷,
根据电荷守恒可知:3n(Fe3+)+3n(Al3+)=2n(SO42-)+n(M),
即:2×3+3×1=2×4+M,
解得:M=1,
M应带有1个单位的负电荷,又OH-离子不能与铁离子大量共存,所以M只能为选项中的硝酸根离子,
故选B.
点评 本题考查离子共存问题,题目难度中等,解答关键是根据电荷守恒判断离子的种类,注意掌握电荷守恒在化学计算中的应用方法,明确离子反应发生条件.

练习册系列答案
相关题目
13. 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )| A. | 放电时负极反应是:Pb-2e-═Pb2+,充电是阴极反应是:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| B. | 闭合K断开K1,电流的流动方向是从B到A | |
| C. | 放电过程中,溶液的pH不断减小 | |
| D. | 放电时,线路上若有1mole-通过,则消耗硫酸也是1mol |
14.对下列图象的描述正确的是( )
| A. |  根据图可判断反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. |  图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响,且p1>p2 | |
| D. |  图 可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 |
11.下列过程或变化一定吸收能量的是( )
| A. | 断裂化学键 | B. | 形成化学键 | C. | 化合反应 | D. | 分解反应 |
18.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 11.2L甲烷含有的氢原子数为2NA | |
| B. | 1mol氧气在化学反应中得到的电子数一定为4NA | |
| C. | 28g丙烯中含有的碳氢键的数目为4NA | |
| D. | 1mol/L的硝酸中含有的硝酸根离子的数目为4NA |
8.下列说法正确的是( )
| A. | H2、D2和T2互称为同素异形体 | B. | 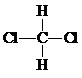 和 和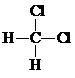 互称为同分异构体 互称为同分异构体 | ||
| C. | 35Cl和37Cl 互称为同位素 | D. | C2H4与C4H8一定能互称为同系物 |
20.下列离子方程式书写正确的是( )
| A. | 酸性高锰酸钾与少量双氧水反应:2MnO4-+3H2O2+6H+═2Mn2++3O2↑+6H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向NaClO溶液中通入过量CO2;CO2+ClO-+H2O═HCO3-+HClO |
