题目内容
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图: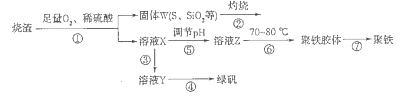
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
(1)4FeS+3O2+12H+=4Fe3++6H2O+4S
(2)燃烧产物SO2会造成环境污染 2:1
(3)铁粉 使Fe3+还原为Fe2+
(4)增大
(5)促进Fe3+水解。又不至于Fe3+完全水解生成氢氧化铁胶体
(6)2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O
解析试题分析:(1)氧化还原反应的特征是元素的化合价的升降。发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S。
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染。在反应3S+6KOH 2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
(3)溶液X为Fe(SO4)3,向其中加入Fe粉使硫酸铁还原为硫酸亚铁,然后蒸发、结晶得到绿矾。
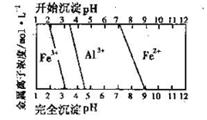
(4)操作⑤是使溶液pH增大以抑制Fe3+的水解。
(5)操作⑥控制温度为70 -80℃的目的是促进Fe3+水解,而又不至于Fe3+完全水解生成氢氧化铁胶体。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2。根据电子守恒和质量守恒定律可得反应的化学方程式为2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O。
考点:考查氧化还原反应的定义、概念、化学方程式、离子方程式的书写、盐的水解及实验的评价等。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下: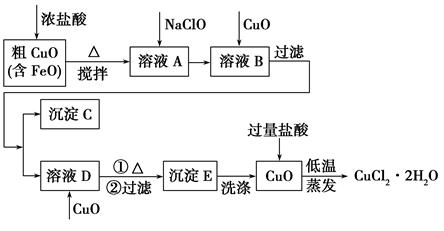
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
(2)沉淀C的化学式为________。
(3)实验室如何检验沉淀E已洗涤干净?________。
(4)低温蒸发的目的是______________________________________。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是________________________________________________。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: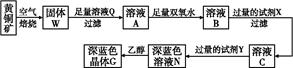
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。(5)在溶液N中加入乙醇的目的是 。
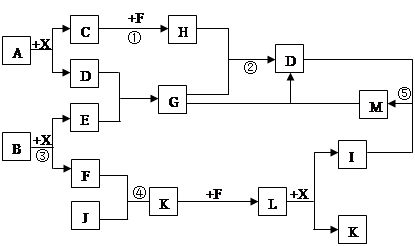



 FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。



