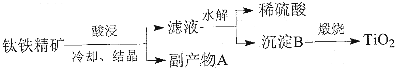题目内容
5.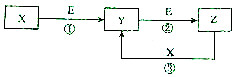 X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
分析 Z为发酵粉的主要成分之一,应为NaHCO3,E为酸性气体,应为CO2,由转化关系可知X为NaOH,Y为Na2CO3,工业在氨气饱和的氯化钠溶液中通入二氧化碳制备NaHCO3,以此解答该题.
解答 解:Z为发酵粉的主要成分之一,应为NaHCO3,俗称小苏打,E为酸性气体,应为CO2,由转化关系可知X为NaOH,Y为Na2CO3,工业在氨气饱和的氯化钠溶液中通入二氧化碳制备NaHCO3,因氨气易溶于水,二氧化碳微溶于水,制备碳酸氢钠时,工业在氯化钠饱和溶液中先通入氨气,再通入二氧化碳,
故答案为:小苏打;饱和氯化钠溶液;NH3;CO2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知33As、35Br位于同一周期,下列关系正确的是( )
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:AsH3>H2S>HC1 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
20.在相同温度下,5.6L CO2和5.6L O2所含的氧原子数( )
| A. | 相等 | B. | 前者多于后者 | C. | 后者多于前者 | D. | 无法比较 |
10.一定温度下,向2L恒容容器中投入X(g),Y(g),M(g),N(g)四种物质,反应 进行至某时刻,测得各物质的量如表实数.
请回答下列问题:
(1)写出该反应的化学方程式:
(2)列式计算N在0~10min内平均反应速率为0.15mol/(L•min);
(3)随着反应进行,容器内气体密度将不变;混合气体平均相对分子质量将减小.(填“增大”“减小”或“不变”)
(4)其他条件不变,若起始向容器中投入4molX(g),消耗一半X时所用时间t<(填“>”“<”或“=”)10min,理由是压强增大,反应速率增大.
(5)向容器中通入惰性气体,下列推断正确的是C.
A.反应速率增大 B.反应速率减小 C.反应速率不变 D.无法判断
(6)按上述反应规律,进行到40min时M为4.75mol.
请回答下列问题:
| 物质的量 时间 | n(X)/mol | n(Y)/mol | n(M)/mol | n(N)/mol |
| 0 | 2.0 | 1.0 | 1.0 | 1.0 |
| 10min | 1.0 | 2.0 | 3.0 | 4.0 |
| 20min | 0.5 | 2.5 | 4.0 | 5.5 |
| 30min | 0.25 | 2.75 | 4.5 | 6.25 |
(2)列式计算N在0~10min内平均反应速率为0.15mol/(L•min);
(3)随着反应进行,容器内气体密度将不变;混合气体平均相对分子质量将减小.(填“增大”“减小”或“不变”)
(4)其他条件不变,若起始向容器中投入4molX(g),消耗一半X时所用时间t<(填“>”“<”或“=”)10min,理由是压强增大,反应速率增大.
(5)向容器中通入惰性气体,下列推断正确的是C.
A.反应速率增大 B.反应速率减小 C.反应速率不变 D.无法判断
(6)按上述反应规律,进行到40min时M为4.75mol.
5.下列反应不属于氧化还原反应的是( )
| A. | 2Na2O2+2CO2═2Na2CO3+O2 | |
| B. | Ca(O H)2+2NH4Cl=CaCl2+2NH3↑+2H2O | |
| C. | Fe2O3+3CO $\frac{\underline{\;加热\;}}{\;}$2Fe+3CO2 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O |
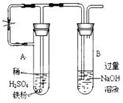 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.