题目内容
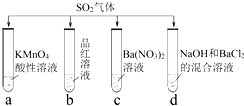 将SO2分别通入下列4种溶液中,有关说法正确的是
将SO2分别通入下列4种溶液中,有关说法正确的是
- A.试管a中实验可以证明SO2具有漂白性
- B.试管b中溶液褪色,说明SO2具有强氧化性
- C.试管c中能产生白色沉淀,说明SO2具有还原性
- D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
C
分析:A.SO2与KMnO4酸性溶液发生氧化还原反应;
B.SO2使品红溶液褪色,表现了SO2的漂白性;
C.SO2被溶液中的NO3-和H+氧化为SO42-,表现了SO2的还原性;
D.SO2与NaOH和BaCl2混合溶液反应生成BaSO3,BaSO3被硝酸氧化为BaSO4,BaSO4难溶于稀硝酸.
解答:A.SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性,故A错误;
B.SO2使品红溶液褪色,表现了SO2的漂白性,故B错误;
C.SO2被溶液中的NO3-和H+氧化为SO42-,表现了SO2的还原性,故C正确;
D.SO2与NaOH和BaCl2混合溶液反应生成BaSO3,BaSO3被硝酸氧化为BaSO4,BaSO4难溶于稀硝酸,故D错误;
故选C.
点评:本题考查了SO2的性质,要注意SO2使有色物质褪色不一定是它的漂白性.
分析:A.SO2与KMnO4酸性溶液发生氧化还原反应;
B.SO2使品红溶液褪色,表现了SO2的漂白性;
C.SO2被溶液中的NO3-和H+氧化为SO42-,表现了SO2的还原性;
D.SO2与NaOH和BaCl2混合溶液反应生成BaSO3,BaSO3被硝酸氧化为BaSO4,BaSO4难溶于稀硝酸.
解答:A.SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性,故A错误;
B.SO2使品红溶液褪色,表现了SO2的漂白性,故B错误;
C.SO2被溶液中的NO3-和H+氧化为SO42-,表现了SO2的还原性,故C正确;
D.SO2与NaOH和BaCl2混合溶液反应生成BaSO3,BaSO3被硝酸氧化为BaSO4,BaSO4难溶于稀硝酸,故D错误;
故选C.
点评:本题考查了SO2的性质,要注意SO2使有色物质褪色不一定是它的漂白性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验. 将SO2分别通入下列4种溶液中,有关说法正确的是( )
将SO2分别通入下列4种溶液中,有关说法正确的是( ) 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.