题目内容
9.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原提取的操作过程如下: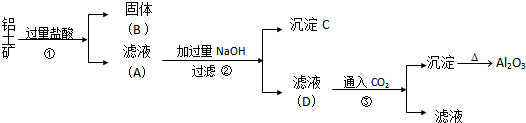
(1)第一步在铝土矿中加入盐酸后的实验基本操作是过滤,若在固体B中加入氢氧化钠溶液会(填”会”或”不会”)发生反应,若会,则写出反应的离子方程式SiO2+2OH-=SiO32-+H2O.
(2)验证滤液A中是否含Fe3+,可取少量滤液A并加入硫氰酸钾(填试剂名称),现象是溶液显血红色.
(3)在整个操作过程中否(填“是”或“否”)有氧化还原反应,写出在滤液D中通入过量的CO2可能发生的反应的化学方程式HCO3-+OH-═H2O+CO32-、AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
(4)将沉淀C与稀盐酸反应所得的物质E制成饱和溶液,滴入沸水中可得到以C为分散质的胶体.下列有关E溶液和该胶体的说法正确的是(填序号)d.
a.都呈红褐色 b.都具有丁达尔效应
c.分散质粒子直径相等 d.都能透过滤纸
(5)当冶炼过程中有0.3mol 的电子发生转移时,则参加反应的氧化铝质量为多少?
分析 铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液.
(1)分离固液用过滤;二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠和水;
(2)三价铁离子遇到硫氰酸根离子显血红色;
(3)依据反应中是否有化合价变化判断是否是氧化还原反应;偏铝酸钠与足量二氧化碳生成氢氧化铝和碳酸氢钠,与少量二氧化碳反应生成碳酸钠和氢氧化铝;
(4)依据氢氧化铁胶体的性质解答;
(5)依据电解氧化铝生成铝的方程式结合转移电子数计算参加反应氧化铝的质量.
解答 解:铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液;
(1)第一步在铝土矿中加入盐酸后得到氯化铝、氯化铁溶液和二氧化硅固体,分离二者用过滤方法;二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH-=SiO32-+H2O,
故答案为:过滤;会;SiO2+2OH-=SiO32-+H2O;
(2)三价铁离子遇到硫氰酸根离子显血红色,可以用硫氰酸钾溶液检验三价铁离子的存在;
故答案为:硫氰酸钾溶液;溶液显血红色;
(3)铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液,该过程中发生的反应均为复分解反应,反应中没有化合价的变化,不属于氧化还原反应;偏铝酸钠溶液、氢氧化钠混合溶液通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠和水;偏铝酸钠溶液、氢氧化钠混合溶液通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式:AlO2-+CO2+2H2O=Al(OH)3+HCO3-;HCO3-+OH-═H2O+CO32-;
故答案为:否;AlO2-+CO2+2H2O=Al(OH)3+HCO3-;HCO3-+OH-═H2O+CO32-;
(4)将沉淀氢氧化铁与稀盐酸反应所得的物质氯化铁制成饱和溶液,滴入沸水中可得到以氢氧化铁为分散质的胶体,
a.氯化铁为黄色,故a错误;
b.胶体具有丁达尔效应,溶液不具有,故b错误;
c.溶液分散质粒度小于1nm,胶体介于1-100nm,故C错误;
d.溶液、胶体分散质粒度都小于滤纸孔径,都能够透过滤纸,故d正确;
故选:d;
(5)电解熔融氧化铝的方法制取金属铝,发生2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
2molAl2O3~~4molAl~~12mol电子
2 12
n 0.3mol
解得:n=0.05mol
氧化铝的质量=0.05mol×102g/mol=5.1g;
答:参加反应的氧化铝质量为5.1g.
点评 本题考查了铝的制备工艺流程,涉及离子方程式的书写、物质的分离、氧化还原反应的有关计算、离子的检验、胶体的性质等,题目综合性强,难度较大.

| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| C. | CO2气体(HCl气体),通过饱和的Na2CO3溶液 | |
| D. | SiO2(H2SiO3),加热 |

 或NH2-NH-NH-NH-NH-NH2.
或NH2-NH-NH-NH-NH-NH2.