题目内容
把7.4 gNa2CO3·10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)="=0.6" mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是
| A.3.18 g | B.2.12 g | C.4.22 g | D.5.28 g |
A
解析试题分析:等质量的固体混合物加热至恒重,最终得固体碳酸钠,根据钠元素守恒,溶液中n(Na+)="0.6" mol·L-1×0.1L=0.06mol,所以碳酸钠的物质的量为0.06mol/2=0.03mol,其质量为0.03mol106g/mol=3.18g,答案选A。
考点:考查碳酸氢钠的受热分解,元素守恒法的应用

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1 时,三种溶液中Cl—的物质的量之比为
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.3∶4∶3 |
下列说法正确的是
| A.浓硫酸的腐蚀性不是化学变化 |
| B.可以通过化学反应完成16O到18O的转变 |
| C.胶体的聚沉属于物理变化 |
| D.焰色反应一定发生化学变化 |
下列说法正确的是
A.2mol 溶液与lmol 溶液与lmol 溶液混合后, 溶液混合后, 2mol 2mol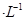 |
| B.120gNaC1溶液中溶有20gNaCl,该温度下NaC1的溶解度为20g |
C.22.4LHCl气体溶于水制成1L溶液,该溶液的物质的量浓度为lmol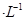 |
D.把5g胆矾( )溶于45g水中,所得溶液溶质的质量分数为10% )溶于45g水中,所得溶液溶质的质量分数为10% |
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
| A.3.0 mol | B.1.5 mol | C.1.0 mol | D.0.75 mol |
下列有关化学用语表示正确的是( )
A.羟基的电子式: |
B.14C的原子结构示意图: |
C.质子数为6、质量数为14的原子: |
| D.熔融状态下硫酸氢钾的电离方程式:KHSO4=K++H++SO42- |
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
| A.1 mol甲醇中含有C—H键的数目为4NA |
| B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C.标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
将5.1 g镁铝合金投入到500 mL 2.0 mol/L的盐酸中,金属完全溶解,再加入4.0 mol/L的NaOH溶液,若要生成的沉淀最多,则应加入NaOH溶液的体积是( )
| A.200 mL | B.250 mL | C.425 mL | D.560 mL |
有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是 ( )。
| A.溶质的质量分数是24.0% |
| B.溶液的物质的量浓度是2.4 mol·L-1 |
| C.溶质和溶剂的物质的量之比是1∶40 |
| D.硫酸根离子的质量分数是19.2% |