题目内容
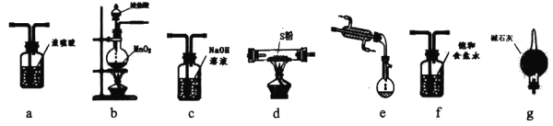
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应;熔点为-80℃,沸点137.l℃。在熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2:b→___;
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___。
【答案】fadeg 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
【解析】
(1) S2Cl2易水解,因此需要严格无水,氯气需除杂并干燥,尾气需吸收过量的氯气并防止空气中的水进入,选择碱石灰进行尾气处理,据此分析和选择仪器;
(2)根据已知信息,结合氧化还原反应规律书写方程式。
(1) S2Cl2易水解,因此需要严格无水,氯气需除杂并干燥,尾气需吸收过量的氯气并防止空气中的水进入,选择碱石灰进行尾气处理,故排序bfadeg;
(2) S2Cl2中S化合价为+1,被氧化与被还原物质的量之比为1:3,产物为SO2与S,故水解方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目