题目内容
已知:
CH3COOH(足量)+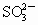
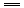 CH3COO-+
CH3COO-+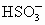
现有下列电解质溶液:①Na2SO3,②NaOH,③CH3COONa,④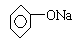 ,⑤NaClO.
,⑤NaClO.
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________.
(2)将上述浓度均为0.2mol·L-1的五种溶液,稀释相同倍数后,其pH变化最大的是________.
(3)露置于空气中相当一段时间后(不考虑水分蒸发)溶液的pH都近似为7,这两种电解质为________,它们在水溶液中水解的离子方程式分别为________,________.
答案:
解析:
解析:
|
(1)③①⑤④②;(2)②;(3)Na2SO3和NaClO, 导解:NaClO与Na2SO3在空气中相当长时间后pH近似为7的原因为: 2NaClO+H2O+CO2 2HClO 2Na2SO3+O2 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
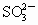 +H2O
+H2O
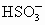 +OH-,ClO-+H2O
+OH-,ClO-+H2O 2HClO+Na2CO3,
2HClO+Na2CO3, 2HCl+O2,
2HCl+O2,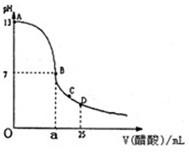 Ⅰ.如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
Ⅰ.如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:


 俗称乳酸,乳酸经过聚合制得的聚乳酸树脂,可以广泛用于医疗、包装、纺织等行业. 若用丙烯(其他无机试剂任选)为原料合成乳酸,合成过程中涉及到的反应类型依次是
俗称乳酸,乳酸经过聚合制得的聚乳酸树脂,可以广泛用于医疗、包装、纺织等行业. 若用丙烯(其他无机试剂任选)为原料合成乳酸,合成过程中涉及到的反应类型依次是
