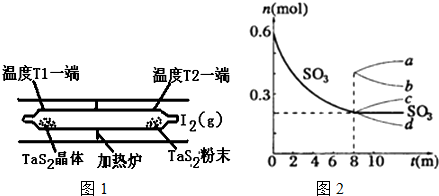
题目内容
7.下列关于金属钠的叙述中,正确的是( )| A. | 钠具有银白色的金属光泽,熔点高于100℃ | |
| B. | 钠具有强还原性,能与CuSO4溶液发生置换反应生成Cu | |
| C. | 将金属钠在空气中加热则生成白色固体 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
分析 A.钠的熔点97.81℃;
B.钠与盐溶液反应先与水反应生成氢气,再与硫酸铜发生复分解反应;
C.钠加热生成过氧化钠;
D.钠和钾的合金可作原子反应堆的导热剂.
解答 解:A.钠的熔点低于100℃,故A错误;
B.钠与盐溶液反应先与水反应生成氢气,再与硫酸铜发生复分解反应,不能置换出铜,故B错误;
C.钠加热生成过氧化钠,过氧化钠为淡黄色,故C错误;
D.钠和钾的合金熔点低,常温下为液态,具有良好的导热性,可作原子反应堆的导热剂,故D正确;
故选:D.
点评 本题考查学生金属钠和及合金的性质,明确物质的性质是解题关键,属于基本知识的考查,难度不大.

练习册系列答案
相关题目
17.汽车安全气囊碰撞时会发生如下反应:10NaN3+2KNO3=5Na2O+X+16N2↑,则下列说法正确的是( )
| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
18.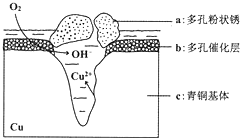 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
12.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
19.除去表中物质中含有杂质,所选试剂错误的是( )
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
17. Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学
表达式:K3=$\frac{[CO]•[{H}_{2}O]}{[{H}_{2}]•[C{O}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表格数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
Ⅱ在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是ACDF(填选项字母).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;t4时刻B.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最低的是D(填选项字母).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
 Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.33 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学
表达式:K3=$\frac{[CO]•[{H}_{2}O]}{[{H}_{2}]•[C{O}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表格数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
Ⅱ在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是ACDF(填选项字母).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;t4时刻B.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最低的是D(填选项字母).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
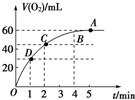 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.