题目内容
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是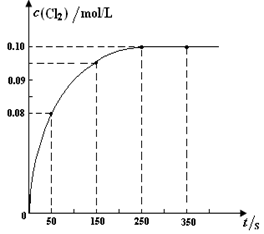
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
C
解析前50s,Cl2生成量为0.08mol/L,则用它表示的速率是1.6×10-3mol/(L·s),A正确;达到平衡时,c(Cl2)= c(PCl3)="0.10mol/L," c(PCl5)=0.5mol/L-0.1mol/L=0.4mol/L,则K=(0.10mol/L)2/0.4mol/L=0.025,B正确;达到平衡时c(PCl3)=0.1mol/L,升高温度后平衡时c(PCl3)=0.11mol/L,说明平衡向正方向移动,正反应是吸热反应,C错;反应达平衡后,再向容器中充入1 mol PCl5,相当于把密闭容器中压强增大,平衡向逆方向移动,所氯气的物质的量浓度应比0.2mol/L要小,比原来0.1mol/L在要大,D正确。答案选C。

 小题狂做系列答案
小题狂做系列答案硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应
2SO2 + O2 2SO3的说法中正确的是
2SO3的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
对于在恒温恒容容器中进行的反应A(g)+2B(g)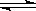 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是
| A.反应容器中,压强不随时间改变而改变 |
| B.单位时间内生成3nmolC的同时生成nmolA |
| C.反应容器中,混合气体的平均相对分子质量不再改变 |
| D.反应容器中的气体密度不随时间变化 |
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
| A.t1min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0~8 min,H2的平均反应速率v(H2)=mol·L-1·min-1 |
| D.10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
一定温度下,反应A2(g)+B2(g)??2AB(g)达到平衡的标志是( )
| A.单位时间内生成n mol A2的同时生成n mol AB |
| B.容器内的总压强不随时间的变化而变化 |
| C.单位时间内生成2n mol AB的同时生成n mol B2 |
| D.单位时间内生成n mol A2的同时生成n mol B2 |
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。
则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强 |
 3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )