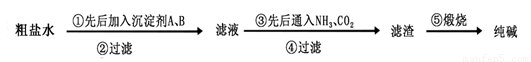
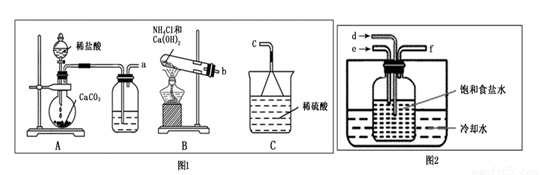
题目内容
25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是( )
| A、升高温度,溶液的pH降低 | B、加入NaOH固体,溶液中的c(Na+)、c(S2-)均增大 | C、c(Na+)>c(S2-)>c(OH-)>c(H+) | D、2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
分析:A.升高温度,促进盐类的水解,溶液pH增大;
B.向溶液中加入少量NaOH固体,抑制Na2S的水解;
C.Na2S溶液存在S2-+H2O?HS-+OH-;
D.从物料守恒的角度分析.
B.向溶液中加入少量NaOH固体,抑制Na2S的水解;
C.Na2S溶液存在S2-+H2O?HS-+OH-;
D.从物料守恒的角度分析.
解答:解:A.升高温度,促进盐类的水解,所以氢氧根离子浓度增大,溶液pH增大,故A错误;
B.向溶液中加入少量NaOH固体,增大了钠离子浓度,c(OH-)增大,抑制Na2S的水解,故B正确;
C.Na2S溶液存在S2-+H2O?HS-+OH-,则有c(OH-)>c(H+),所以c(Na+)>c(S2-)>c(OH-)>c(H+),故C正确;
D.物料守恒可知Na的物质的量是S的物质的量的2倍,S在溶液存在形式有3种,所以
c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误.
故选BC.
B.向溶液中加入少量NaOH固体,增大了钠离子浓度,c(OH-)增大,抑制Na2S的水解,故B正确;
C.Na2S溶液存在S2-+H2O?HS-+OH-,则有c(OH-)>c(H+),所以c(Na+)>c(S2-)>c(OH-)>c(H+),故C正确;
D.物料守恒可知Na的物质的量是S的物质的量的2倍,S在溶液存在形式有3种,所以
| 1 |
| 2 |
故选BC.
点评:本题考查离子浓度大小的比较,题目难度不大,注意从物料守恒的角度分析,把握盐类水解的原理,易错点为D,注意离子浓度的变化.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目