题目内容
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
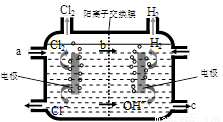
⑶右图为工业上氯碱工业的电解槽示意图,据图回答:
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
⑴CH3OH(l)+3 2O2(g)=CO2(g)+2H2O(l) ΔH=726.4kJ?mol-1(2分)
⑵O2+4e-+2H2O=4OH-(1分)
⑶①饱和食盐水、钠离子、氢氧化钠溶液(各1分)
②Cl2+2NaOH ="NaClO" +NaCl+H2O(2分) ⑷①吸②气③气、气(各1分)
解析

练习册系列答案
相关题目
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
 ,氢气的燃烧热
,氢气的燃烧热 )
)
 B+C
在某一温度时达到平衡。
B+C
在某一温度时达到平衡。 (9分).已知下列物质的物理常数如下:苯甲酸:白色固体,密度1.2659,熔点122℃,沸点249℃。甲醇:无色液体,密度0.7915, 熔点-97.8℃,沸点64.65℃。苯甲酸甲酯:无色液体,密度1.0888,熔点-12.3℃,沸点199.6℃。乙酸:熔点16.6℃,沸点117.9℃。乙醇:熔点一117.3℃,沸点78.5℃。乙酸乙酯:熔点-83.6℃,沸点77.1℃
(9分).已知下列物质的物理常数如下:苯甲酸:白色固体,密度1.2659,熔点122℃,沸点249℃。甲醇:无色液体,密度0.7915, 熔点-97.8℃,沸点64.65℃。苯甲酸甲酯:无色液体,密度1.0888,熔点-12.3℃,沸点199.6℃。乙酸:熔点16.6℃,沸点117.9℃。乙醇:熔点一117.3℃,沸点78.5℃。乙酸乙酯:熔点-83.6℃,沸点77.1℃ ②用上述装置制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有_____________;
②用上述装置制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有_____________;