题目内容
16.向Na2O2中通入足量的CO2,充分反应,若要制得2.24L(标准状况)氧气,需要加入的Na2O2的质量是多少?生成Na2CO3的物质的量是多少?( 写明计算过程)分析 向Na2O2中通入足量的CO2,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,据此反应的方程式计算.
解答 解:向Na2O2中通入足量的CO2,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,由方程式可知,若要制得2.24L(标准状况)氧气,需要加入的Na2O2的质量是$\frac{2.24L}{22.4L/mol}$×2×78g/mol=15.6g,生成Na2CO3的物质的量是$\frac{2.24L}{22.4L/mol}$×2=0.2mol,
答:需要加入的Na2O2的质量是15.6g,生成Na2CO3的物质的量是0.2mol.
点评 本题考查按方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
6.短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X与Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性.下列说法正确的是( )
| A. | 离子半径由大到小的顺序为R、Z、Y、W | |
| B. | X、Y分别与Z形成的多种化合物在化学键类型都相同 | |
| C. | 由X、Y、Z、R四种元素形成的两种化合物在水中不能发生反应 | |
| D. | Z、W、R最高价氧化物对应的水合物两两之间均能发生反应 |
4.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 高温下0.3molFe与足量水蒸气完全反应,失去的电子数为0.8NA | |
| B. | 常温下,0.2molNaHSO4固体中含有的离子数为0.6NA | |
| C. | 标准状况下,2.24LCCl4中含有极性共价键的数目为0.4NA | |
| D. | 25℃时,pH=12的Ba(OH)2溶液中含有的氢氧根离子数为0.01NA |
11.可逆反应mA(s)+nB(g)?pC(g)+qD(g),在反应过程中,当其他条件不变时,C的百分含量(c%)与温度(T)压强(P)的关系如图,下列叙述正确的是( )

| A. | 达到平衡后,加入催化剂则c%增大 | |
| B. | 该反应的△H<0 | |
| C. | 化学方程式中n>p+q | |
| D. | 达到平衡后,增加A的量有利于平衡向正反应方向移动 |
1. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH溶液 | AlCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
5.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+,Fe2+,Cl-,ClO- | B. | Na+,Cu2+,SO42-,NO3- | ||
| C. | Mg2+,NH4+,SO42-,Cl- | D. | Ba2+,CO32-,NO3-,K+ |
7.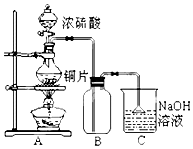 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000mL,取20.00mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是不能,pH>5时,铜离子与碱反应生成沉淀,不能达到滴定终点.
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.