题目内容
【题目】(1)现有以下物质:①熔化的NaOH ②稀H2SO4溶液 ③KNO3 固体 ④汞(金属)⑤酒精(C2H5OH)溶液 ⑥干冰,请回答下列问题(用序号填空):
①属于电解质的是______________________;
②属于非电解质的是___________________。
(2)有四种物质是:①标况下6.72L CH4;②3.01×1023个HCl;③13.6g H2S;④0.2mol NH3,其中含有原子数最多的是_________,质量最大的是________。(用序号填空)
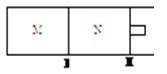
(3)如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,若M容器中充入O2,N容器中充入SO2,若两容器中所含气体质量相等,则M容器和N容器的体积比为___________;若M容器中充入CO2,N容器中充入CO和H2两种混合气体,若隔板不再移动时两容器体积比为1:1, 则M,N容器中原子总数比为___________。
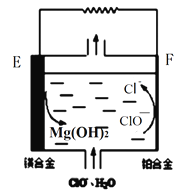
(4)标况下,体积_____L的CO气体含电子数与1.7克氢氧根离子OH- 含的电子数相同。
(5)9.5 g MCl2中含有Cl-的物质的量为0.2mol,则该氯化物的摩尔质量为________ g/mol,其中含M2+ 的质量为______g.
【答案】①、③ ⑥ ① ② 2:1 3:2 1.6 95 2.4
【解析】
(1)根据电解质、非电解质的概念进行判断;
(2)利用n=![]() =
=![]() 进行计算,并比较大小;
进行计算,并比较大小;
(3)隔板I、Ⅱ均可自由移动,则容器为恒压,利用阿佛加德罗定律及推论计算;
(4)利用微粒间的倍数关系计算;
(5)利用M=m/n计算。
(1)①熔化的NaOH为化合物,且能导电,属于电解质;
②稀H2SO4溶液属于混合物,不是电解质,也不是非电解质;
③KNO3固体为化合物,且熔融状态或水溶液里均能导电,属于电解质;
④汞(金属)为单质,既不是电解质,也不是非电解质;
⑤酒精(C2H5OH)溶液属于混合物,不是电解质,也不是非电解质;
⑥干冰为化合物,液态时不导电,属于非电解质;
综上所述,电解质为①、③;非电解质为⑥;
(2)①标况下6.72L CH4的物质的量为0.3mol,原子的物质的量为1.5mol,质量为4.8g;
②3.01×1023个HCl物质的量为0.5mol,原子的物质的量为1mol,质量为18.25g;
③13.6g H2S其分子的物质的量为0.4mol,原子的物质的量为1.2mol;
④0.2mol NH3,原子的物质的量为0.8mol,质量为3.4g;
综上所述,原子数最多的为①;质量最大的为②;
(3)隔板I、Ⅱ均可自由移动,则容器为恒压,在保持温度相同时,容器的体积之比等于物质的量之比,n(O2):n(SO2)=m/32:m/64=2:1;若隔板不再移动时两容器体积比为1:1,则物质的量相等,CO2为3原子分子,则原子的物质的量为3nmol,CO和H2为双原子分子,则原子的物质的量为分子的2倍,则原子的物质的量为2nmol,M,N容器中原子总数比为3:2;
(4)1.7克氢氧根离子(OH-)的物质的量为0.1mol,一个氢氧根离子含有10个电子,则电子数目为离子数目的10倍,则含的电子数为1mol,一个CO中含有14个电子,电子为1mol时的体积为1/14×22.4=1.6L;
(5)9.5g MCl2中含有Cl-的物质的量为0.2mol,则MCl2的物质的量为0.1mol,M=m/n=9.5g/0.1mol=95g/mol;Cl的摩尔质量为35.5g/mol,则M的摩尔质量为24g/mol,M2+的质量=0.1mol×24g/mol=2.4g。

【题目】硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。

回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是______________________。
(2)B中的试剂可能是__________,酸性KMnO4溶液的作用是_____________。
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是___________、___________。
Ⅱ.探究实验二:制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取Na2S2O3(装置如下图,夹持装置省略)。

①装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为___________。
②除搅拌和使用多孔球泡外,再写出一种可以提高B中吸收SO2效率的方法___________。
(2)探究Na2S2O3的性质(反应均在溶液中进行),请填空:
Na2S2O3性质 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液的酸碱性 | ____ | pH=8 |
探究2 | Na2S2O3的还原性 | 向新制的溴水中滴加Na2S2O3溶液 | __________ |