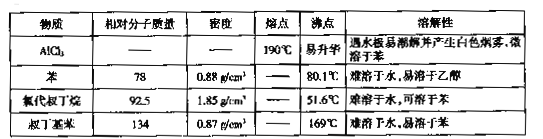
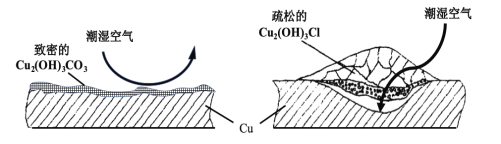
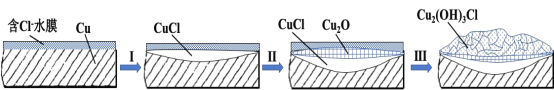
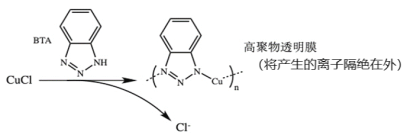
题目内容
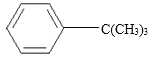
【题目】化合物A是基本有机化工原料,由A合成高分子化合物C和![]() 的合成路线如下图(部分反应条件略去):
的合成路线如下图(部分反应条件略去):

已知:①R-CN![]() R-COOH
R-COOH
②![]()
回答下列问题:
(1)A的化学名称是____________。
(2)C分子中所含官能团的名称是____________;D的结构简式是____________。
(3)B![]() C和G
C和G![]() H的反应类型分别是____________、____________。
H的反应类型分别是____________、____________。
(4)A![]() E的化学方程式是_________________________________________。
E的化学方程式是_________________________________________。
(5)F![]() G的化学方程式是_________________________________________。
G的化学方程式是_________________________________________。
(6)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种(不含立体异构);其中某种同分异构体M与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1,则M的结构简式是______________________________。
【答案】丙烯 酯基  加聚反应 取代反应 CH2=CHCH3+Cl2
加聚反应 取代反应 CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl CH2=CHCH2OH+
CH2=CHCH2Cl+HCl CH2=CHCH2OH+![]()
![]()
![]() 8
8 ![]() 、
、![]()
【解析】
A为C3H6,A发生加成反应生成的B为CH3CH=CHCOOCH3,则A结构简式为CH2=CHCH3,B发生加聚反应生成的C为聚丁烯酸甲酯,其结构简式为 ,聚丁烯酸甲酯发生碱性水解反应然后酸化得到聚合物D,D的结构简式为
,聚丁烯酸甲酯发生碱性水解反应然后酸化得到聚合物D,D的结构简式为 ;A与Cl2在光照条件下发生反应生成E,D发生水解反应生成F,F和C4H5Cl发生信息②的加成反应生成G,则F分子结构中含有一个碳碳双键,C4H5Cl分子结构中含有两个碳碳双键,结合F分子式C3H6O可知,F结构简式为CH2=CHCH2OH、E结构简式为CH2=CHCH2Cl,X为2-氯-1,3-丁二烯(
;A与Cl2在光照条件下发生反应生成E,D发生水解反应生成F,F和C4H5Cl发生信息②的加成反应生成G,则F分子结构中含有一个碳碳双键,C4H5Cl分子结构中含有两个碳碳双键,结合F分子式C3H6O可知,F结构简式为CH2=CHCH2OH、E结构简式为CH2=CHCH2Cl,X为2-氯-1,3-丁二烯(![]() ),F和X发生加成反应生成G,G与NaCN发生取代反应生成H,H在酸性条件下水解生成
),F和X发生加成反应生成G,G与NaCN发生取代反应生成H,H在酸性条件下水解生成 ,由此推出H为
,由此推出H为![]() ,G为
,G为![]() ,由此分析解题。
,由此分析解题。
(1)A的结构简式为CH2=CHCH3,其化学名称是丙烯;
(2)C的结构简式为 ,分子中含有的官能团的名称是酯基;D的结构简式是
,分子中含有的官能团的名称是酯基;D的结构简式是 ;
;
(3)B为CH3CH=CHCOOCH3,发生加聚反应生成 ;G为
;G为![]() ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成![]() ;
;
(4)A为CH2=CHCH3,在光照条件下与氯气发生取代反应生成CH2![]() CH2=CHCH2Cl+HCl;
CH2=CHCH2Cl+HCl;
(5)F为CH2=CHCH2OH,其和2-氯-1,3-丁二烯(![]() )发生加成反应生成
)发生加成反应生成![]() 的化学方程式是CH2=CHCH2OH+
的化学方程式是CH2=CHCH2OH+![]()
![]()
![]() ;
;
(6)B为CH3CH=CHCOOCH3,其分子式为C5H8O2,分子结构中含有酯基,则它的同分异构体中,与B具有相同的官能团且能发生银镜反应,说明含有HCOO-,烃其分子式为C4H7O—,其中结构C=C-C-C中连接HCOO-有4种、C-C=C-C中连接HCOO-有2种,C=C(C)2中连接HCOO-有2种,即满足条件的B的同分异构体共有8种;其中![]() 和
和![]() 与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1。
与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
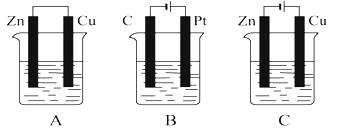
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。
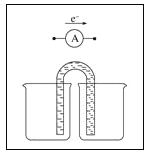
(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。