题目内容
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝并检验其纯度。查阅资料:
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2高温,2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O===NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
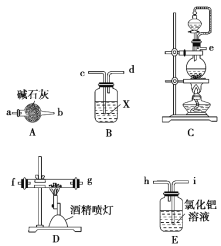
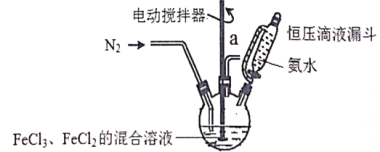
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→a→b→____________________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是_____________,E装置内氯化钯溶液的作用可能是_____。
Ⅱ.氮化铝纯度的测定
(方案ⅰ)甲同学用如图装置测定AlN的纯度(部分夹持装置已略去)。
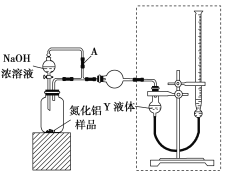
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是________。
a.CCl4 b.H2O
c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是________(填“偏大”“偏小”或“不变”)。
(方案ⅱ)乙同学按以下步骤测定样品中AlN的纯度。
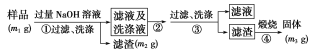
(5)步骤②通入过量________气体。
(6)步骤③过滤所需要的主要玻璃仪器有____________。
【答案】f(g)→g(f)→a(c)→b(d)→i 浓硫酸 吸收CO,防止污染 ad 偏大 CO2 烧杯、玻璃棒、漏斗
【解析】
利用装置C制备氮气,通过装置B中浓硫酸干燥气体,通过装置A中的碱石灰除去酸性气体,通过装置D氮气和铝发生反应,利用装置A或B防止空气中水蒸气进入装置D,最后通过装置E吸收多余的CO,防止污染空气;样品加入氢氧化钠溶液反应AlN+NaOH+H2O = NaAlO2+NH3↑,测定生成气体为NH3,液体不能选用水溶液、不能和氨气反应,样品溶于过量氢氧化钠溶液中过滤得到滤液偏铝酸钠溶液,滤液及其洗涤液中通入过量二氧化碳生成氢氧化铝沉淀,过滤得到固体灼烧得到氧化铝。
(1)利用装置C制备氮气,通过装置B中浓硫酸干燥气体,通过装置A中的碱石灰除去酸性气体,通过装置D氮气和铝发生反应,利用装置A或B防止空气中水蒸气进入装置D,最后通过装置E吸收多余的CO,防止污染空气,按照氮气气流方向将各仪器接口连接,因此氮气气流方向将各仪器接口连接:e→c→d→a→b→f(g)→g(f)→a(c)→b(d)→i;故答案为:f(g)→g(f)→a(c)→b(d)→i。
(2)根据第1题得出B装置内的X液体可能是浓硫酸,NO气体有毒,E装置内氯化钯溶液的作用可能是吸收CO,防止污染;故答案为:浓硫酸;吸收CO,防止污染。
(3)样品加入氢氧化钠溶液反应AlN+NaOH+H2O = NaAlO2+NH3↑,测定生成气体为NH3,液体不能选用水溶液、不能和氨气反应,为准确测定生成气体的体积,量气装置中的Y液体可以是ad;故答案为:ad。
(4)若装置中分液漏斗与导气管之间没有导管A连通,溶液流下过程中集气瓶中压强增大,会排出装置内空气,导致测定氨气体积增大,所测AlN纯度的增大;故答案为:偏大。
(5)样品m1g溶于过量氢氧化钠溶液中过滤得到滤液偏铝酸钠溶液,滤渣质量m2g,滤液及其洗涤液中通入过量二氧化碳生成氢氧化铝沉淀,过滤得到固体灼烧得到氧化铝为m3g,步骤②操作目的是将偏铝酸钠转化成氢氧化铝沉淀,则通入的是过量CO2气体;故答案为:CO2。
(6)步骤③“过滤”操作需要的主要玻璃仪器是:烧杯、玻璃棒、漏斗;故答案为:烧杯、玻璃棒、漏斗。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
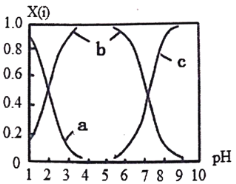
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
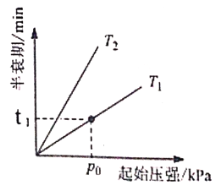
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2