题目内容
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
A.10min时,容器内的压强是反应前的0.9倍
B.10min 时,X 的转化率为80%
C.10min内,用Y表示的平均反应速率为0.03 mol·L-1·s-1
D.前5分钟内,X 和Y 反应放出的热量等于0.1a kJ
【答案】A
【解析】
根据题意,该反应的三段式为:
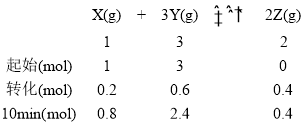
A、在恒温恒容的容器中,容器内总压强和体系的总物质的量呈正比,刚开始体系的总物质的量为4mol,10min时体系的总物质的量为3.6mol,则10min时,容器内的压强是反应前的0.9倍,A正确;
B、10min时,α(X)=![]() =20%,B错误;
=20%,B错误;
C、10min内,v(Y)=![]() = 0.03 mol·L-1·min-1,C错误;
= 0.03 mol·L-1·min-1,C错误;
D、反应物的浓度越大,反应速率也越大;10min时Y反应了0.6mol,则5min时,Y的转化量大于0.3mol,即X的转化量大于0.1mol,所以前5min内,X 和Y 反应放出的热量大于0.1a kJ,D错误;
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
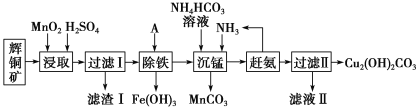
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。