题目内容
1.下列有机物命名正确的是( )| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | B. |  2-甲基戊烷 2-甲基戊烷 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
分析 (1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A. 1,3,4-三甲苯,该命名中取代基的编号之和不是最小,正确命名应该为:1,2,4-三甲苯,故A错误;
1,3,4-三甲苯,该命名中取代基的编号之和不是最小,正确命名应该为:1,2,4-三甲苯,故A错误;
B. 主链有5个碳原子的烷烃,2号碳上有1个甲基,其名称为:2-甲基戊烷,故B正确;
主链有5个碳原子的烷烃,2号碳上有1个甲基,其名称为:2-甲基戊烷,故B正确;
C. 主链为4个碳原子的醇,羟基在2号碳原子上,其名称为:2-丁醇,故C错误;
主链为4个碳原子的醇,羟基在2号碳原子上,其名称为:2-丁醇,故C错误;
D. 主链为4个碳的炔,碳碳三键在1号碳上,3号碳上有1个甲基,其名称为:3-甲基-1-丁炔,故D错误;
主链为4个碳的炔,碳碳三键在1号碳上,3号碳上有1个甲基,其名称为:3-甲基-1-丁炔,故D错误;
故选:B.
点评 本题考查了考查有机物的命名,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

练习册系列答案
相关题目
11.溴化钙是一种重要的化工原料,制备CaBr2•2H2O 的主要流程如图:下列说法不正确的是( )


| A. | 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2 | |
| B. | 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结品、洗涤、干燥 | |
| C. | 制得的CaBr2•2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2•2H2O的纯度 | |
| D. | 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2+6H2O |
12.在密闭容器中,反应2A+B?2C达到平衡后,增大压强,平衡向生成C的方向移动.对于A、B、C三种物质的状态判断正确的是( )
| A. | A是气体 | B. | B是气体 | ||
| C. | 如果C是气体,A、B一定是气体 | D. | 如果C是气体,B不一定是气体 |
9.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.元素是构成我们生活的世界中一切物质的“原材料”.
Ⅰ、自18世纪以来,科学家们不断探索.从局部到系统,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
上述科学家的研究按照时间先后排序合理的是②③④①(填数字序号).
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如表所示.
(1)门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是预测此处应有一个相对原子质量为68的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间).
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大.X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨.
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ,元素Z的离子结构示意图为
,元素Z的离子结构示意图为 .
.
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O.
(3)元素W位于周期表的第ⅤA族,其非金属性比元素R弱,用原子结构的知识解释原因P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱.
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式SO2+NH3•H2O=HSO3+NH4+.
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件.工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN↑+3CO.
Ⅰ、自18世纪以来,科学家们不断探索.从局部到系统,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如表所示.
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大.X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨.
请回答下列问题:
(1)元素X的最高价氧化物的电子式为
 ,元素Z的离子结构示意图为
,元素Z的离子结构示意图为 .
.(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O.
(3)元素W位于周期表的第ⅤA族,其非金属性比元素R弱,用原子结构的知识解释原因P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱.
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式SO2+NH3•H2O=HSO3+NH4+.
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件.工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN↑+3CO.
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 四氯化碳、苯和乙醇均能用来萃取富集天然色素 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶的实验中,苯甲酸停留在滤纸上 | |
| D. | 在苯甲酸重结晶的实验中,粗苯甲酸完全溶解后要冷却到常温才过滤 |
19.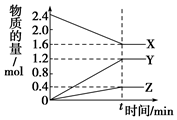 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )| A. | 该反应的化学方程式为:2X?3Y+Z | |
| B. | 10s内Y的平均速率为0.12 mol•L-1•min-1 | |
| C. | X的转化率为66.7% | |
| D. | 增大压强,该反应速率一定加快 |
20.下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2②CH3CH2CH═CH2③ ④CH3CH3.
④CH3CH3.
①SO2②CH3CH2CH═CH2③
 ④CH3CH3.
④CH3CH3.| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
 硫酸工业在国民经济中占有极其重要的地位.
硫酸工业在国民经济中占有极其重要的地位.